Historique.
Historique.
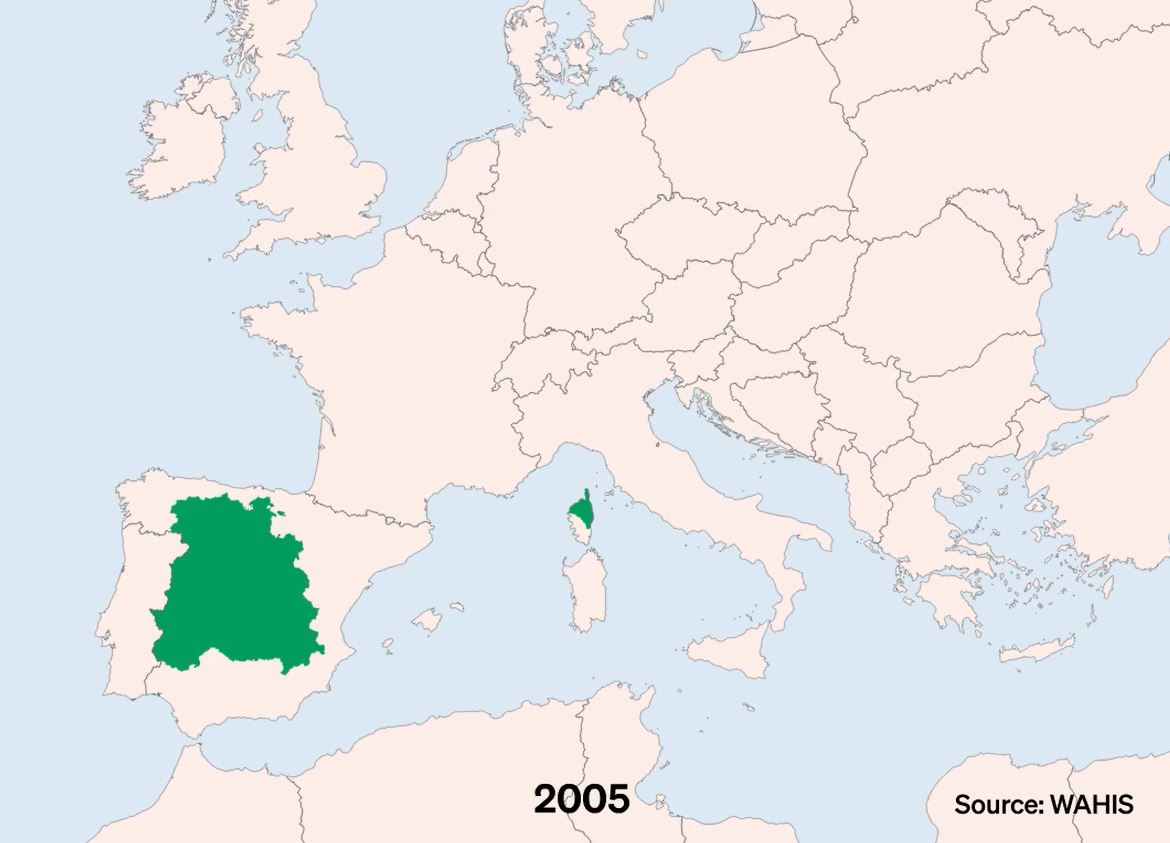
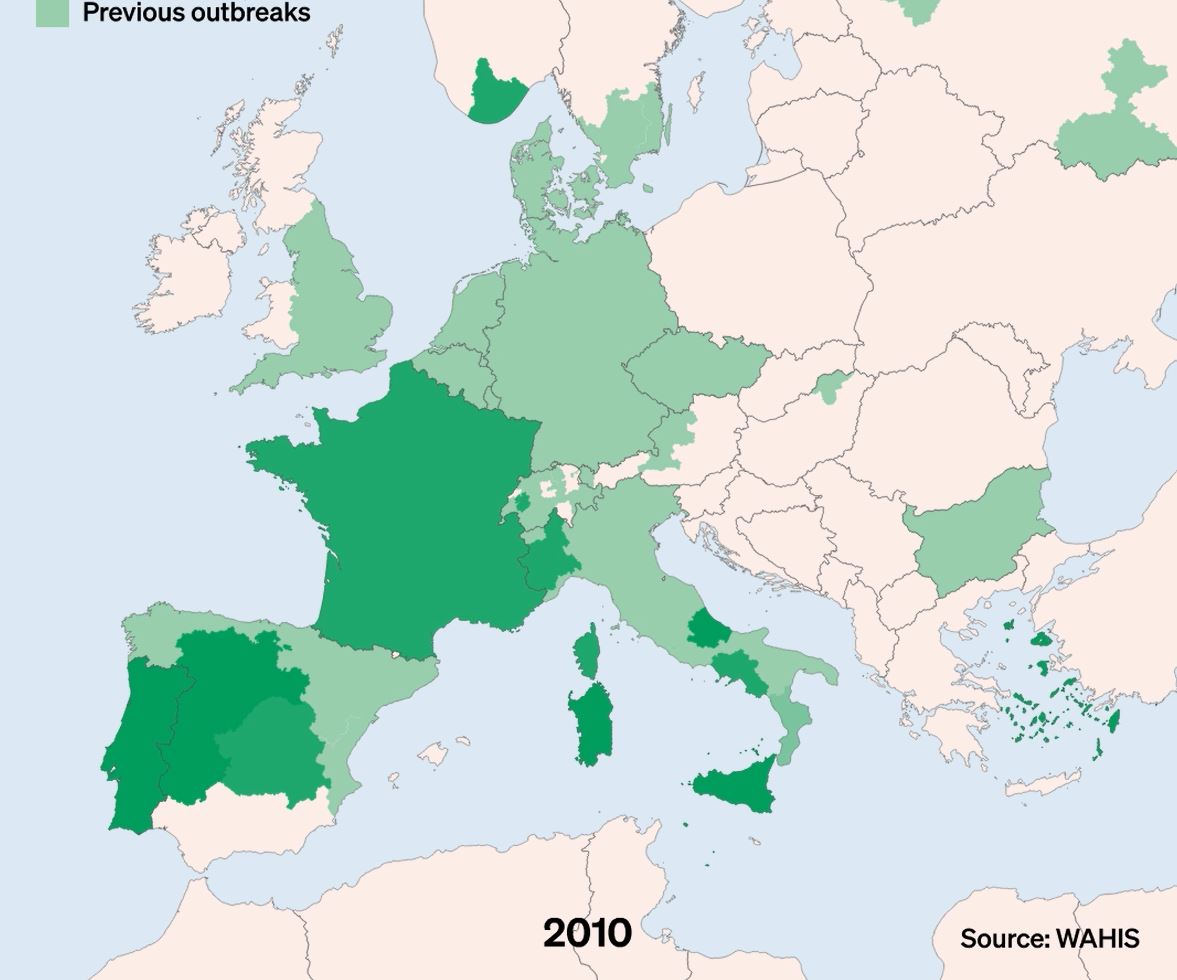
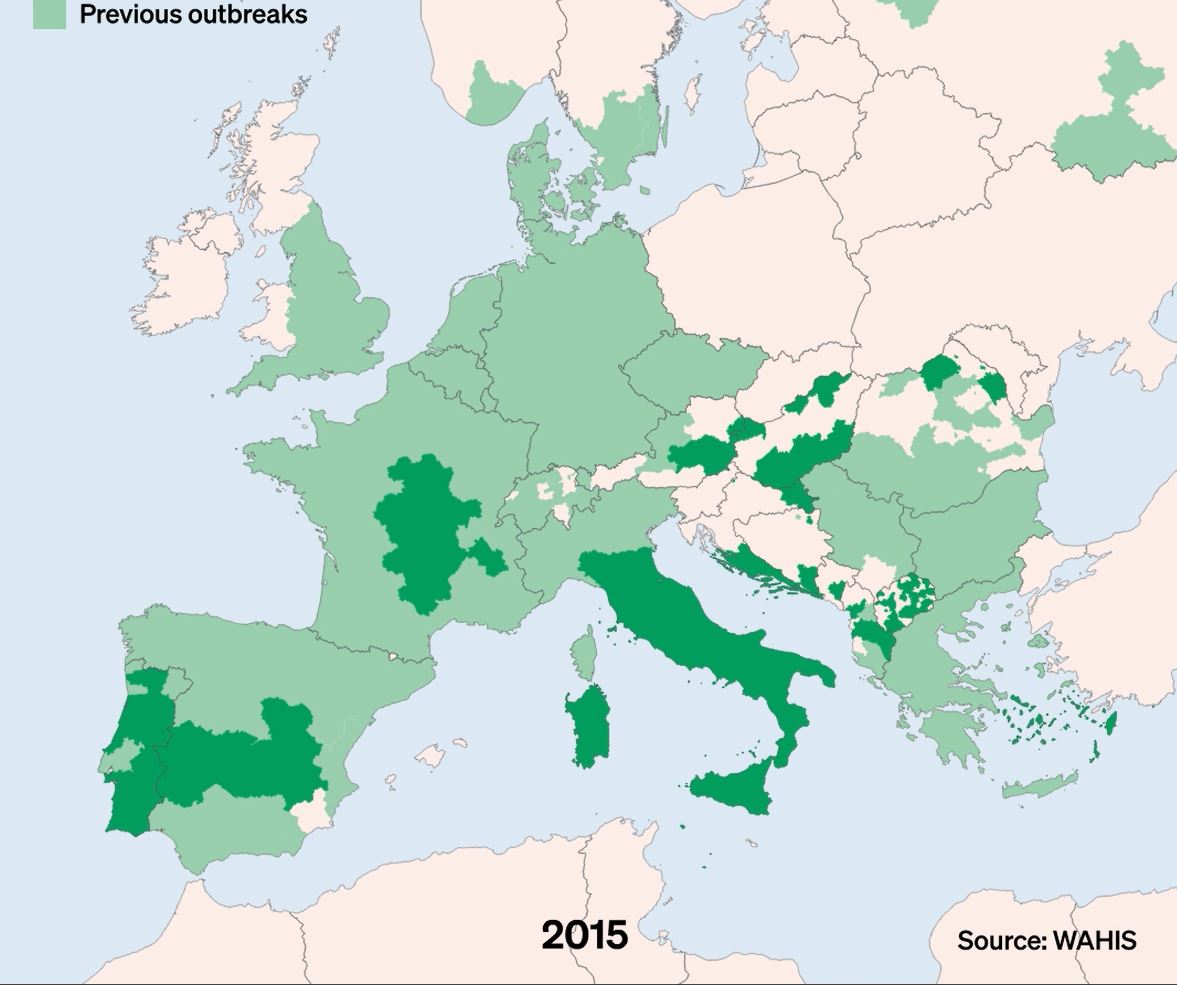
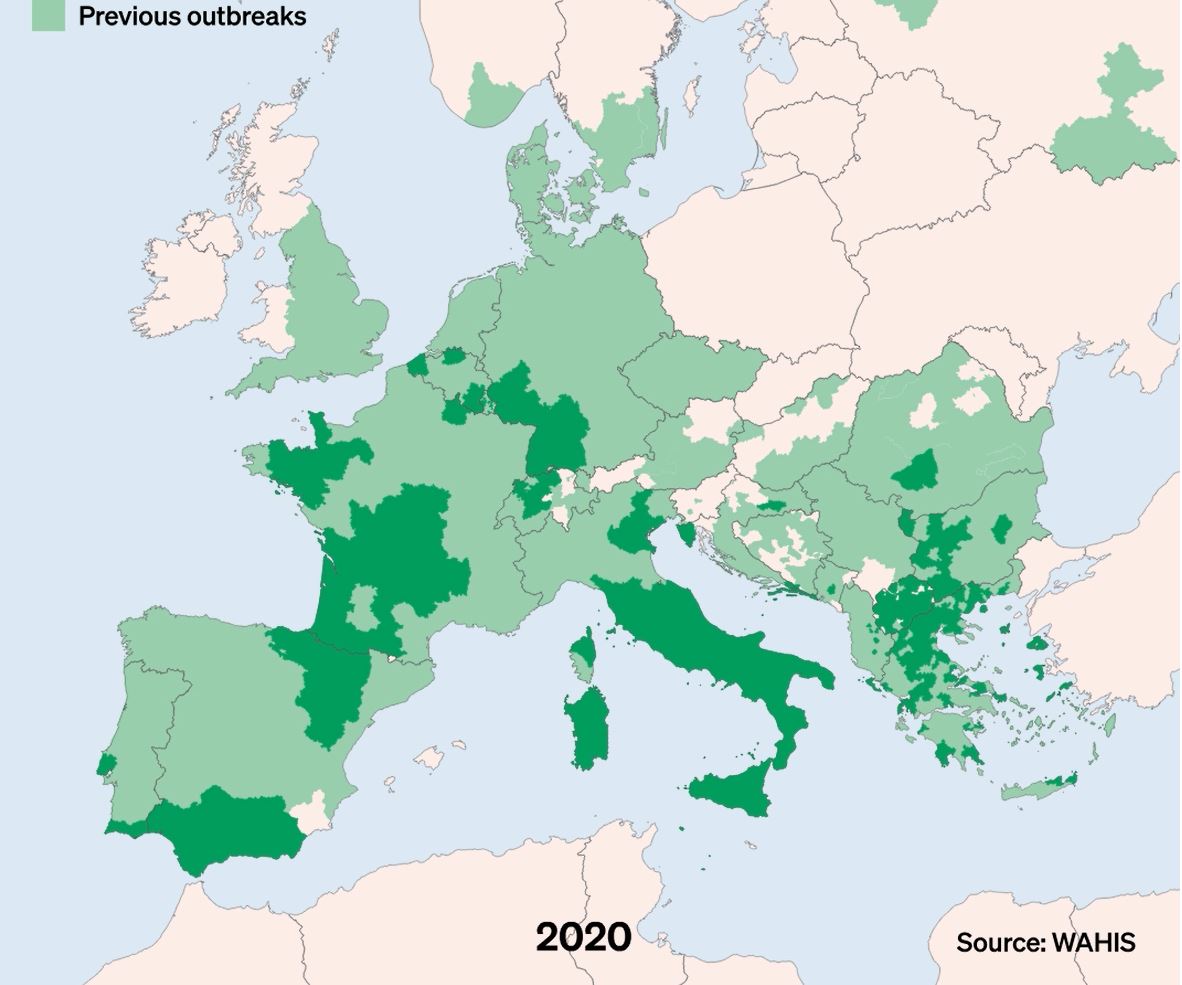
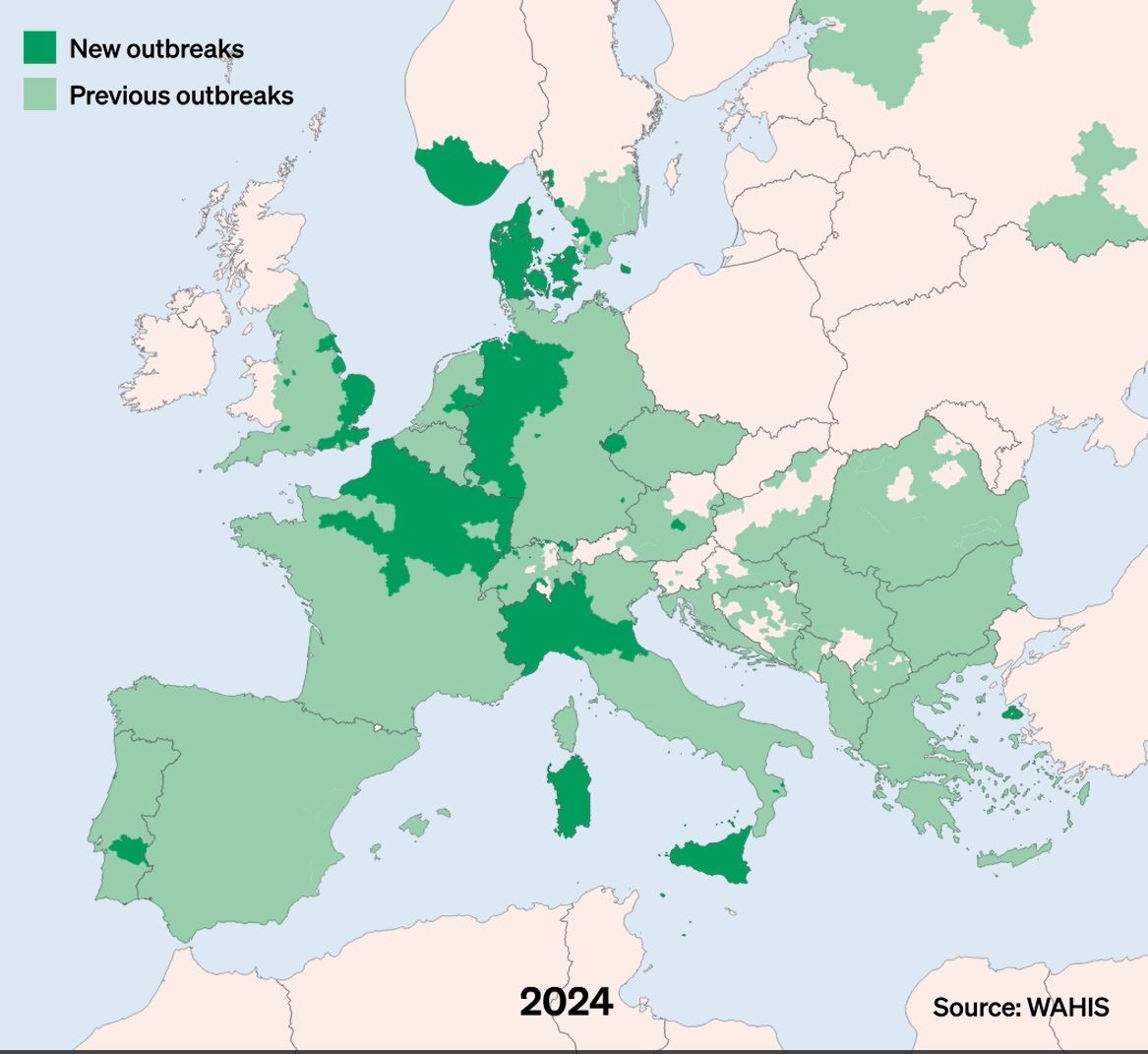
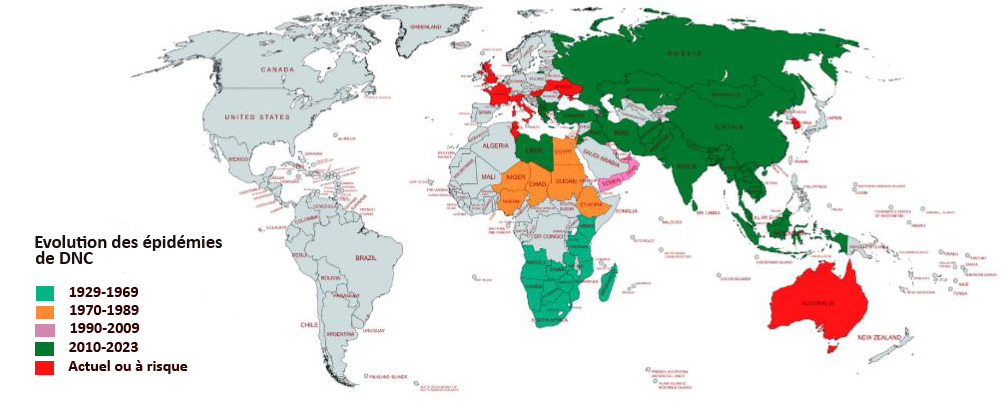
La DNC, Dermatose Nodulaire Contagieuse, (en anglais, Lumpy Skin Disease, LSD) a été signalée pour la première fois en 1929 en Zambie. Sa première apparition hors d’Afrique a été signalée en Israël entre 1986 et 1988 et s’est progressivement propagée au Moyen-Orient, puis en Europe de l’Est et en Russie, avant de se propager dans les Balkans. En 2019, de nouveaux cas ont été signalés en Asie du Sud et de l’Est, représentant une menace permanente pour tous les pays indo-asiatiques, dont l’Afghanistan, le Pakistan et l’Inde. L’identification de cas actifs en Asie (Chine, Cambodge, Singapour et Indonésie) a suscité des inquiétudes quant à l’intrusion de ce virus dans des pays indemnes de DNC et possédant d’importantes populations bovines naïves, comme l’Australie : Depuis, elle a fait irruption dans les pays Européens, dont l’Espagne, l’Italie et la France, dans des régions proches de la Suisse.
Le virus.
La dermatose nodulaire contagieuse est causée par un virus de la famille des Orthopox virus, dont on connait bien les virus de la variole humaine et de la variole du singe . C’est donc un virus à ADN avec un génome très fourni permettant la synthèse de près d’une centaine de protéines, qui le rend pratiquement indépendant des fonctions des cellules qu’il infecte, à l’exclusion de la production d’énergie et de l’utilisation de la machine de synthèse des protéines. Le virus peut être excrété par les sécrétions nasales et lacrymales, le lait et le sperme, et sa viabilité est observée jusqu’à 11 jours dans le lait et 22 jours dans le sperme. Il n’existe aucune preuve de la présence du virus dans la viande d’animaux infectés, mais le virus peut être isolé à partir de surfaces infectées, notamment dans le matériel d’élevage et de transport. Le virus résiste à l’inactivation et peut rester viable jusqu’à 35 jours dans des croûtes cutanées desséchées, plus de 33 jours dans des nodules cutanés nécrotiques et au moins 18 jours dans des peaux séchées à l’air. Il peut persister dans l’environnement pendant de plus longues périodes, notamment dans l’obscurité des étables contaminées, où il peut persister plusieurs mois. Cette persistance fait du virus de la DNC une menace importante pour la biosécurité de l’industrie mondiale de l’élevage. Le virus ne provoque de maladie que chez les espèces bovines, les bovins et les buffles d’eau (Bos taurus, Bos indicus). Le virus partage pourtant des caractéristiques avec des virus de la même famille infectant les chèvres ou les moutons.
Transmission.
La maladie contagieuse est transmise par divers vecteurs tels que les mouches piqueuses, les poux, les tiques, les moustiques et les guêpes, mais aussi par contact étroit avec des animaux infectés ou des mangeoires et des abreuvoirs contaminés. Les vaches en lactation peuvent également transmettre le virus aux veaux allaités par le lait contaminé et par des lésions cutanées de la tétine. Une transmission verticale a été démontrée expérimentalement par la transmission de sperme infecté lors d’une saillie naturelle ou d’une insémination artificielle. Le virus peut persister jusqu’à 42 jours après l’infection dans le sperme. Le temps chaud et humide responsable de la multiplication des vecteurs et d’une augmentation de leur activité, rend la saison des pluies d’été et d’automne ainsi que les basses terres marécageuses épidémiologiquement plus propices à l’apparition de cette maladie.
La maladie.
La DNC se caractérise par une morbidité élevée et une faible mortalité. Selon la réponse immunitaire de l’hôte, les animaux atteints peuvent présenter une forme clinique aiguë ou chronique. Fièvre, anorexie, lympho-adénopathie, rhinorrhée et lésions cutanées distinctes caractérisent le stade aigu de l’infection, tandis que les animaux au stade chronique présentent une faible production de lait et une infertilité. Les veaux ont tendance à présenter des signes cliniques plus graves que les adultes. L’impact économique se traduit par une baisse de la production laitière, une mauvaise qualité des peaux et de la viande, des avortements et des décès.
Lutte.
Empêcher la propagation de la DNC dans une zone indemne ou éradiquer la maladie dans une zone nécessite plusieurs mesures de contrôle : une quarantaine stricte, la restriction des déplacements des animaux, la vaccination avec des vaccins vivants atténués (cf. ci-dessous), l’isolement et l’abattage des animaux atteints, l’élimination appropriée des carcasses, le nettoyage et la désinfection des locaux et, sans oublier, la lutte contre les insectes. Parfois, l’abattage de troupeaux entiers est recommandé, mais en cas d’endémie, les élevages touchés isolent souvent les animaux malades et leur administrent un traitement symptomatique, pouvant inclure des pansements pour prévenir les infestations de mouches et les infections secondaires. Le profil d’émergence, les antécédents de réémergence et le risque d’incursion de la DNC dans les pays non infectés augmentent progressivement. Il est donc urgent d’identifier de nouvelles mesures permettant de tracer rapidement l’infection et d’élaborer des stratégies de contrôle efficace. L’information génomique est une ressource essentielle, récemment utilisée pour le traçage, le typage et l’identification rapides du point de mutation des agents infectieux, ainsi que pour élaborer des stratégies de contrôle et d’éradication appropriées (cf. ci-dessous tests DIVA).
Vaccins et controverses vaccinales
Selon l’Organisation Mondiale de la Santé Animale (OMSA), une vaccination appropriée permet de contrôler la DNC en conférant aux bovins une bonne immunité contre le virus. Récemment, des vaccins vivants atténués, homologues (vaccination des bovins avec un vaccin à base de virus DNC) et hétérologues (vaccination des bovins avec un vaccin à base de virus de la variole ovine/caprine)ont été utilisés pour contrôler l’épidémie dans les régions endémiques . Le vaccin homologue atténué disponible est constitué de la souche sud-africaine Neethling. Ce vaccin dit Neethling est celui le plus couramment utilisé. Il est produit après 61 passages en série dans des cellules rénales d’agneau, suivis de 20 passages sur la membrane chorioallantoïque d’œufs de poule embryonnés, pour finir par trois passages sur les cellules rénales d’agneau initiales. Son efficacité a été démontrée. Ses effets indésirables vont d’une réaction cutanée locale à des nodules cutanés généralisés de petite taille, accompagnés d’une diminution de la production de lait. Plusieurs études ont démontré la présence de virus vaccinal dans les nodules cutanés, le sang et le lait d’animaux vaccinés. Il n’est pas fait mention de cas d’animaux ayant reçu la souche vaccinale au contact de ces animaux vaccinés, ce qui pourrait représenter l’avantage de faciliter le maintien de la souche vaccinale dans une population de bovins. Les souches de vaccins hétérologues O-240 et O-180 de la variole du mouton et de la chèvre, respectivement, sont utilisées dans des régions où la variole du mouton ou de la chèvre sévit également.
Les vaccins inactivés ne sont pas encore décrits dans le manuel de l’OMSA, mais certains fabricants les ont développés. Ces derniers peuvent être privilégiés dans les pays indemnes de DNC lorsqu’il existe un risque d’introduction de la DNC en provenance des pays voisins. Les vaccins inactivés confèrent une immunité plus courte que les vaccins vivants atténués. Par conséquent, les vaccinations initiales comprennent deux injections espacées d’un mois, suivies d’une revaccination tous les six mois pour maintenir l’immunité. Pour le contrôle qualité des vaccins, l’OMSA peut faciliter la prise de contact avec les laboratoires de référence en Afrique du Sud et au Royaume-Uni, ainsi qu’avec un centre collaborateur en Belgique (Validation, évaluation et contrôle qualité des tests diagnostiques et des vaccins contre les maladies vésiculaires en Europe). Une des questions soulevées par la vaccination concerne la distinction entre animaux vaccinés et animaux infectés, les deux groupes affichant des anticorps anti-virus DNC. Des tests PCR pouvant distinguer les deux groupes sont à disposition. Ils ont noms tests « PCR-DIVA » (pour Differentiating Infected from Vaccinated Animals).
En Suisse.
Un communiqué de presse a été publié le 18 juillet 2025 par l’Office fédéral de la sécurité alimentaire et des affaires vétérinaires (OSAV) concernant les dispositions à prendre pour lutter contre la DNC, pour laquelle à ce jour aucun cas n’a été reporté. Ce communiqué annonce qu’une zone de surveillance qui englobe le canton de Genève et la région limitrophe de Terre Sainte dans le canton de Vaud est promulguée. Dans cette zone la vaccination est obligatoire pour tous les bovins, buffles et bisons. Comme aucun vaccin contre la DNC n’est autorisé en Suisse, décision a été prise d’autoriser l’importation et l’utilisation des vaccins qui se sont avérés efficaces pour lutter contre des foyers de DNC en Europe(???). Cette mesure « vise à créer une zone tampon et à empêcher autant que possible que cette maladie hautement contagieuse ne se propage en Suisse ». « L’OSAV a également fixé des restrictions concernant le trafic des animaux et des marchandises dans la zone de surveillance, fondées sur la législation sur les épizooties.
Les recommandations visant à protéger le plus possible les animaux contre les piqûres d’insectes et en particulier à respecter les mesures de biosécurité restent de mise. Les détenteurs d’animaux sont tenus d’annoncer immédiatement tout cas suspect au vétérinaire de l’exploitation. »https://www.woah.org/fr/maladie/dermatose-nodulaire-contagieuse/
Affaire à suivre donc.
NB. La réalisation de cet article s’est appuyée essentiellement sur un article de revue de 2023 de:
Mahfuza Akther, Syeda Hasina Akter, Subir Sarker , Joshua W. Aleri , Henry Annandale, Sam Abraham and Jasim M. Uddin. 2023. Global Burden of Lumpy Skin Disease, Outbreaks, and Future Challenges. Viruses 15(9), 1861. https://doi.org/ 10.3390/v15091861.
Publié le 01/08/2025
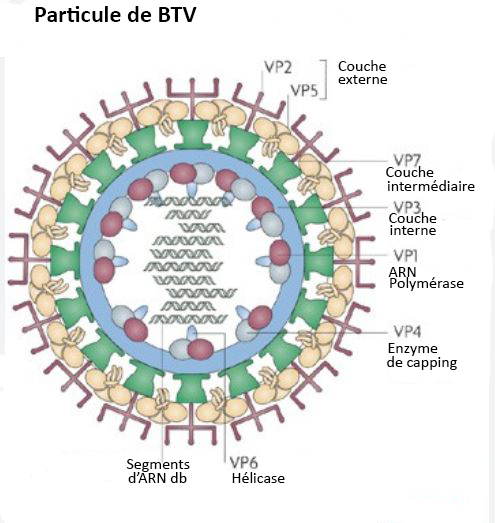
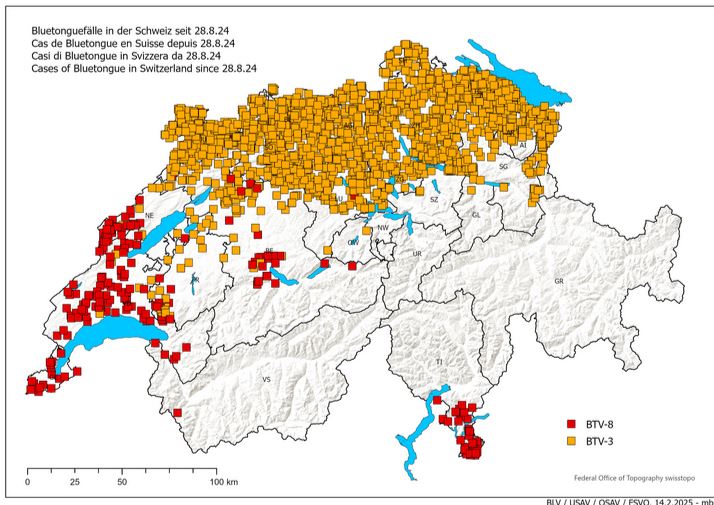
 La langue bleue (bluetongue en anglais) est une maladie virale qui touche les ruminants domestiques (moutons, chèvres, bovins) ou sauvages. Le virus responsable de cette maladie, le Bluetongue virus (BTV), appartient à la famille des Reoviridae, genre Orbivirus.
La langue bleue (bluetongue en anglais) est une maladie virale qui touche les ruminants domestiques (moutons, chèvres, bovins) ou sauvages. Le virus responsable de cette maladie, le Bluetongue virus (BTV), appartient à la famille des Reoviridae, genre Orbivirus.