Pour rappel, un vaccin permet de sensibiliser un organisme à la venue d’un intrus, en déroulant une réaction de défense rapide et efficace aboutissant à son élimination, ceci sans que l’organisme ne subisse les effets néfastes de l’intrusion.
Pour rappel, un vaccin permet de sensibiliser un organisme à la venue d’un intrus, en déroulant une réaction de défense rapide et efficace aboutissant à son élimination, ceci sans que l’organisme ne subisse les effets néfastes de l’intrusion.
Le système de défense capable de cet exploit est dit adaptatif . Il est composé de deux bras actifs, la production d’anticorps et de cellules destructrices (cytotoxiques). Les deux bras agissent de manière spécifique, ce qui veut dire que leur action est ciblée sur un intrus précis, en l’occurrence un virus particulier. Le rôle principal des anticorps consiste à se fixer sur la surface du virus, empêchant ce dernier d’entrer dans la cellule et accessoirement le rendant plus appétissant pour des cellules (macrophages) qui le gobent et le digèrent. Les cellules cytotoxiques, des lymphocytes, reconnaissent les cellules infectées et les détruisent, annulant de ce fait les usines à virus qu’elles représentent. La vaccination a pour but de rendre opérationnel ce système de défense, spécifiquement et intensément en quelques heures, alors que le même système de défense se met en place après cinq à dix jours lors d’une première rencontre avec l’intrus.
Vacciner signifie donc inoculer à l’organisme une version de l’intrus conforme à l’identité telle que détectée par le système de défense, mais dépourvue de sa capacité à provoquer la maladie ou, au minimum, pourvue de la capacité de provoquer une maladie beaucoup moins sévère. Le premier exemple documenté de vaccination chez l’humain concerne celle contre le virus de la variole, en utilisant un virus de la vaccine bovine, connue pour infecter les femmes qui trayaient leurs vaches. Ces dernières se voyaient protégées du virus de la variole (30% de mortalité) après infection par le virus de la vaccine bovine (maladie bénigne), une observation faite par Edward Jenner à la fin du 18ème siècle. Cette opération a été possible parce que les virus de la vaccine et de la variole partagent une même identité.
Dans le milieu du 20ème siècle, les épidémies de poliomyélite touchant principalement les pays dits développés, ont provoqué un regain d’intérêt pour les vaccins. (Cf. Poliomyélite en Ukraine). C’est ainsi que la plupart des vaccins antiviraux que nous connaissons datent de la deuxième moitié du 20ème siècle. Depuis des progrès technologiques importants, supportés par une meilleure connaissance des virus, ont permis la mise au point de vaccins de nature différente qui ont de la peine à s’imposer pour des raisons de frilosité devant la nouveauté (vaccins issus du génie génétique oouh là, là, danger), mais également pour des raisons économiques, tant les tests nécessaires à démontrer leur sécurité sont coûteux, au regard des gains escomptés. De plus, « on ne change pas une équipe qui gagne », c’est bien connu. Les périodes de grande crise épidémique, voir pandémique (H1N1 2009, Ebola 2014-2016, puis 2018, Coronavirus 2003-2019) sont donc charnière pour qu’augmentent les incitations à innover et les moyens mis à disposition. C’est aussi durant ces périodes que les tests de validité peuvent être entrepris, pour de vrai, avec des collectifs humains. C’est un fait que les recherches de vaccins contre le SARS-Cov-1 en 2003 n’ont finalement pas abouti, faute d’intérêt et par manque de patients humains, une fois la crise passée.
Mais il est question d’un vaccin contre le SARS-CoV-2. On peut commencer de manière très classique. Le virus est connu, il a été isolé, il peut être reproduit sur des cultures de cellules, on peut donc disposer de préparations de virus purifié dans des tubes à essai. De là, deux possibilités « historiques » s’ouvrent, la production de virus inactivés ou de virus atténués.
-
- Les vaccins inactivés
- Le virus est inactivé par traitement chimique (Figure 1, 1a.). Inactivation signifie que le virus reste entier, mais que les protéines ont été figées et ne sont plus fonctionnelles. Le virus ne peut plus faire d’infection. Il s’agit d’un vaccin inactivé.
- Le virus est solubilisé par un détergent doux pour permettre la purification des spicules (Figure 1, 1b.). On parle ici de vaccins sous-unités.
- Le génie génétique permet actuellement d’isoler le gène viral produisant la protéine S et de l’introduire dans des cellules en culture (levures, mammifères, insectes). La protéine S est produite et les spicules sont purifiés à partir de ces cultures (Figure 1, 1c.). Pour cette opération, pas besoin de virus. Seule l’information génétique de la protéine S est requise. C’est par cette technique qu’est produit à l’heure actuelle le vaccin contre le virus de l’hépatite B. On parle ici de protéine recombinante..
Le virus inactivé ou les spicules purifiés, mélangés à un adjuvant, dont le rôle est de titiller le système immun pour que la réaction de défense soit déclenchée, sont injectés menant à la production d’anticorps contre les protéines formant les spicules. La production de ces anticorps est mise en mémoire et va être activée très rapidement lorsque l’organisme vacciné rencontre le virus. Les anticorps se fixent sur le virus, empêchent l’infection et favorisent la digestion des virus par le macrophage (Figure 1, Virus neutralisé). Les vaccins inactivés contre les virus de la poliomyélite et contre la grippe ont été et sont préparés selon la méthode de la Figure 1, 1a. Des vaccins dits de « sous-unités » sont également disponibles contre les virus de l’influenza (Figfure 1, 1b.)
- Les vaccins atténués.
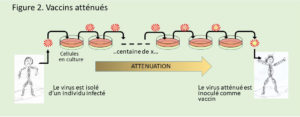
- Un deuxième procédé a été et est encore utilisé. Il s’agit de forcer le virus à se multiplier dans des conditions différentes de celles qu’il rencontre dans l’hôte humain. Le virus va s’adapter à ces nouvelles conditions et se« désadapter » de l’hôte humain. Ces infections sont faites dans des cultures de cellules animales (hamster, poulet, singe, bovin etc.) en prenant le virus produit lors d’une infection pour faire l’infection suivante, en série, plus d’une centaine de fois (Figure 2). Le virus est ainsi forcé à se multiplier dans des cellules d’une autre espèce. De plus, ce système cellulaire simple, diffère de l’organisme entier, notamment par l’absence d’un système de défense immune complet.
Au final, au sein de la population virale, un virus bien adapté à la culture cellulaire est sélectionné, encore capable de faire une infection chez l’humain, mais à bas bruit, juste ce qu’il faut pour déclencher la défense immune, sans pour autant provoquer la maladie. C’est cette stratégie qui a été utilisée dans les années 1960 pour produire le vaccin contre les virus de la rougeole, des oreillons et les vaccins atténués contre les virus de la poliomyélite. Cette formule de vaccin est toujours utilisée avec succès de nos jours. Une autre approche voit le processus d’atténuation effectué à une température de moins de 30°C. Le virus s’y adapte et se multiplie dès lors difficilement à 34°C et encore moins à 37°C, températures, respectivement, des voies respiratoires supérieures et inférieures. Un vaccin de ce type existe contre les virus de la grippe. Non agréé en Europe, il l’est aux USA.
- Selon l’approche précédente, l’atténuation est aléatoire. Elle résulte des mutations introduites au hasard lors de la multiplication virale (cf. La quasi espèce..). La sélection par le système de culture du virus le mieux adapté aux conditions de multiplication fait le reste. Avec les outils du génie génétique et les connaissances actuelles sur le système de défense immune, une approche raisonnée de l’atténuation peut être envisagée. Elle se fonde sur le fait que la réponse adaptative mentionnée ci-dessus est précédée d’une réponse dite innée qui intervient dans les heures qui suivent l’infection. La réponse de défense innée est très efficace et elle est à l’origine de la réponse adaptative. Pour faire leur infection, les virus doivent passer cette première ligne de défense. Ils ont tous développé une stratégie pour la neutraliser ou la contourner tant soit peu. Pratiquement, une ou plusieurs protéines virales sont dévolues à cette tâche. Ces protéines virales identifiées, l’atténuation du virus peut dès lors être réalisée en privant le virus de sa (ses) protéine(s) de diversion. L’infection est ralentie, voire arrêtée, au niveau du système de défense innée, avant qu’elle ait pu se propager dans l’organisme, mais après qu’elle ait réussi à titiller les systèmes de défense pour y imprimer sa marque. Pour le SARS-CoV-2 il est donc impératif de connaître la-les protéine-s qui joue-nt le rôle de diversion de la réponse innée. La-les retirer du génome viral ne pose pas de problème particulier.
- Les vaccins recombinants.
- Cette technique s’appuie sur l’utilisation d’un virus inoffensif pour l’humain, du moins dans sa forme recombinante, un virus véhicule. Le gène nécessaire à la production de la protéine S du SARS-CoV-2 se voit inséré dans le génome de ce véhicule, en remplacement (ou pas) du gène équivalent de ce véhicule. Une description de cette approche a été décrite précédemment (cf. rVSV-ZEBOV). En l’occurrence, le gène, produisant la protéine de surface GP du ZEBOV, inséré dans le génome du virus de la stomatite vésiculaire (VSV), serait remplacé par celui produisant la protéine S de SARS-CoV-2. D’autres virus véhicules peuvent être envisagés (notamment un virus Adéno, aussi sur la liste des vaccins contre Ebola) , mais le fait que le rVSV-ZEBOV ait finalement été agréé comme vaccin contre le virus Ebola, pourrait faciliter les procédures de validation d’un tel vaccin, appelons-le rVSV-SARS-Cov-2.
- Autres approches envisagées
- Les vaccins ADN. Dans une telle approche, le vaccin serait constitué de l’information génétique nécessaire à produire la protéine S. Cette information, sous forme d’ADN, est injectée dans les cellules et ce sont ces dernières qui produisent la protéine S qui déclencherait la réponse immune. Cette approche n’est pas nouvelle. Dans les années 1980, des publications ont fait état d’études de ce type sur des animaux vaccinés contre un virus de la grippe, ceci avec un certain succès. Une polémique s’est alors déclarée au sujet du mode d’administration d’un tel vaccin. Un injecteur en forme de pistolet a fait le buzz, tant il est apparu impossible à des médecins et à de patients potentiels de vacciner avec un tel engin, symbole de violence. A l’heure actuelle, des publications sont nombreuses qui rapportent des essais de vaccination basée sur cette technique contre certains virus aviaires (H7Nx) dans les élevages de volailles.
- Les vaccins ARN. Dans cette formulation, l’ADN contenant l’information pour produire la protéine virale est remplacée par de l’ARN messager. Pour rappel, l’information génétique contenue dans l’ADN doit être décodée pour être intelligible et servir à la production de protéine. Ce décodage passe par une molécule d’ARN dit messager (ARNm, cf. Le Génome). C’est justement sous forme de cet ARNm que se trouve le vaccin administré. La protéine S serait produite à partir de l’ARNm injecté. Un tel ARNm constituerait en plus un adjuvant susceptible de favoriser la réponse immune.
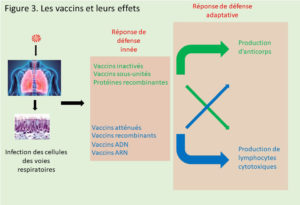
Jusqu’à aujourd’hui, la majorité des vaccins anti viraux stimulent la production d’anticorps (on parle d’immunité humorale) par les lymphocytes de type B (LyB). Des vaccins qui stimulent également la prolifération de lymphocytes de type T (LyT), immunité cellulaire), cellules destructrices des cellules infectées (cytotoxiques), sont bien sûr désirables, mais pas si facile à réaliser. Les vaccins atténués devraient le faire avec plus d’efficacité, de même que les vaccins à ADN ou à ARN (cf. Figure 3).
Les vaccins inactivés ont pour eux la facilité de préparation et leur sécurité. Les vaccins atténués ont l’avantage de pouvoir être administrés par la même route que celle du virus sauvage, stimulant les mêmes réponses immunes, dans les mêmes tissus, par exemple un spray dans les voies respiratoires. La méthode historique risque d’être trop longue par les temps qui courent. De plus, le risque, minime, de retour à l’état sauvage du virus atténué est-il encore d’actualité ? Le vaccin recombinant du genre rVSV ou autres virus véhicules comme des virus respiratoires du type virus Parainfluenza (rSeV, rPIV1), peu ou pas pathogènes pour l’humain, devraient retenir la préférence des chercheurs.
La liste des approches vers la production d’un vaccin est ainsi fournie. Difficile à prédire laquelle de ces pistes va aboutir. Le succès va dépendre de différents facteurs viraux qui restent encore à explorer. La protéine S est-elle immunogène, i.e. promeut-elle efficacement la montée d’anticorps ? Quelle est la durée de ces anticorps ? L’antigénicité (la carte d’identité) de S est-elle stable (comme celle du virus de la rougeole) ou évolue-t-elle comme celle des virus de la grippe ? La vaccination va-t-elle promouvoir une réponse immune adéquate, trop faible ou trop puissante ? On comprend que la disponibilité d’un vaccin ne passe pas seulement par l’obtention d’une préparation vaccinale, mais par des études rigoureuses, sur des cohortes animales, dans un premier temps (existe-t-il un bon modèle animal ?), puis sur des cohortes d’humains exposés au risque d’infection. Dans ce contexte il vaudrait mieux miser sur plusieurs candidats. L’effort de recherche doit être intense et il ne faudrait pas que les confinements stricts soient un frein à cette recherche, en fermant, par exemple, les laboratoires universitaires où se font la majorité des recherches fondamentales sur le sujet.