Disons d’emblée que, pour un virologue averti, l’émergence des variants fait partie du jeu. Il n’y a, pour s’en convaincre, que de prendre le temps de lire deux ou trois articles de ce blog : La quasi-espèce, une hétérogénéité génétique extrême, Les propriétés de la quasi-espèce, Les virus ont une capacité d’adaptation formidable. Si après cette lecture passionnante, il vous reste un peu d’énergie, vous pouvez vous lancer dans le présent article. Celui-ci est une tentative d’appréhender de manière plus concrète les mécanismes qui sous-tendent l’apparition de ces variants. Pour simplicité et pour coller à l’actualité, on va se focaliser sur les virus dont le génome est composé d’ARN, sachant que des mécanismes similaires interviennent dans l’évolution des virus à ADN.
Disons d’emblée que, pour un virologue averti, l’émergence des variants fait partie du jeu. Il n’y a, pour s’en convaincre, que de prendre le temps de lire deux ou trois articles de ce blog : La quasi-espèce, une hétérogénéité génétique extrême, Les propriétés de la quasi-espèce, Les virus ont une capacité d’adaptation formidable. Si après cette lecture passionnante, il vous reste un peu d’énergie, vous pouvez vous lancer dans le présent article. Celui-ci est une tentative d’appréhender de manière plus concrète les mécanismes qui sous-tendent l’apparition de ces variants. Pour simplicité et pour coller à l’actualité, on va se focaliser sur les virus dont le génome est composé d’ARN, sachant que des mécanismes similaires interviennent dans l’évolution des virus à ADN.
Donc, l’hétérogénéité génétique de la population virale au cours de l’infection est un fait acquis. Elle résulte essentiellement de la sélection, au cours de l’évolution, d’une enzyme virale de duplication du génome qui introduit des erreurs contrôlées. Il faut imaginer une photocopieuse qui introduirait, au hasard, le changement d’une lettre à chaque copie d’un texte long de 10’000 lettres. Déjà, en utilisant toujours le même texte de départ, et en le photocopiant 1000 fois, on obtiendrait 1000 photocopies de textes différant par au moins une lettre à des endroits différents. Si on imagine maintenant que les copies, sont elles-mêmes photocopiées, de même que les copies de copies le sont etc., on peut sans peine visualiser l’énorme diversité de textes qui peut résulter de plusieurs milliers de cycles de photocopies. Voilà, pour le mécanisme d’introduction de la diversité génétique de la population virale. Il faut à ce point introduire un facteur limitant cette diversité en exigeant que le message véhiculé par le texte soit toujours parfaitement intelligible, car il contient des informations de la plus haute importance. On peut faire avec quelques fautes d’orthographes, mais tout charabia incompréhensible est éliminé. On peut imaginer également que certains changements sont totalement prohibés, alors que d’autres sont tolérés. Certains peuvent même améliorer la compréhension du texte, et ceux-là sont bienvenus et seront conservés. Au final, parmi les dizaines de milliers de photocopies générées, celles permettant la compréhension optimale du texte seront légion et vont représenter la majorité, puisqu’elles obéissent le plus strictement à la règle de sélection. Cette majorité est entourée d’une multitude de copies différentes, comprenant quelques fautes d’orthographes. La photocopieuse, associée au critère de sélection, a généré une population hétérogène de copies, composée d’une majorité de photocopies presque parfaites, accompagnée d’une nuée de copies, chacune en petite quantité, une multitude de copies minoritaires.
Poussons plus loin l’analogie, et introduisons le transfert du document dans un autre service où il va devoir être photocopié pour distribution. Ajoutons, pour la beauté du geste, que le texte transmis est sélectionné au hasard parmi les milliers de copies générées précédemment. Selon toute probabilité, le texte transféré va correspondre à celui présent sur la majorité des copies et donc correspondre au texte original. Il n’en reste pas moins que ce transfert représente un appauvrissement significatif de la diversité générée précédemment. Mais tout recommence, et si la photocopieuse de ce nouveau service possède les mêmes caractéristiques que la précédente, et si les critères de sélection restent les mêmes, il y a de fortes chances pour que la majorité des photocopies correspondent à celles de l’épisode précédent. Quant aux copies minoritaires, soumises à une sélection moins stricte, elles peuvent composer une population hétérogène où les fautes d’orthographes peuvent différer de celles produites la première fois.
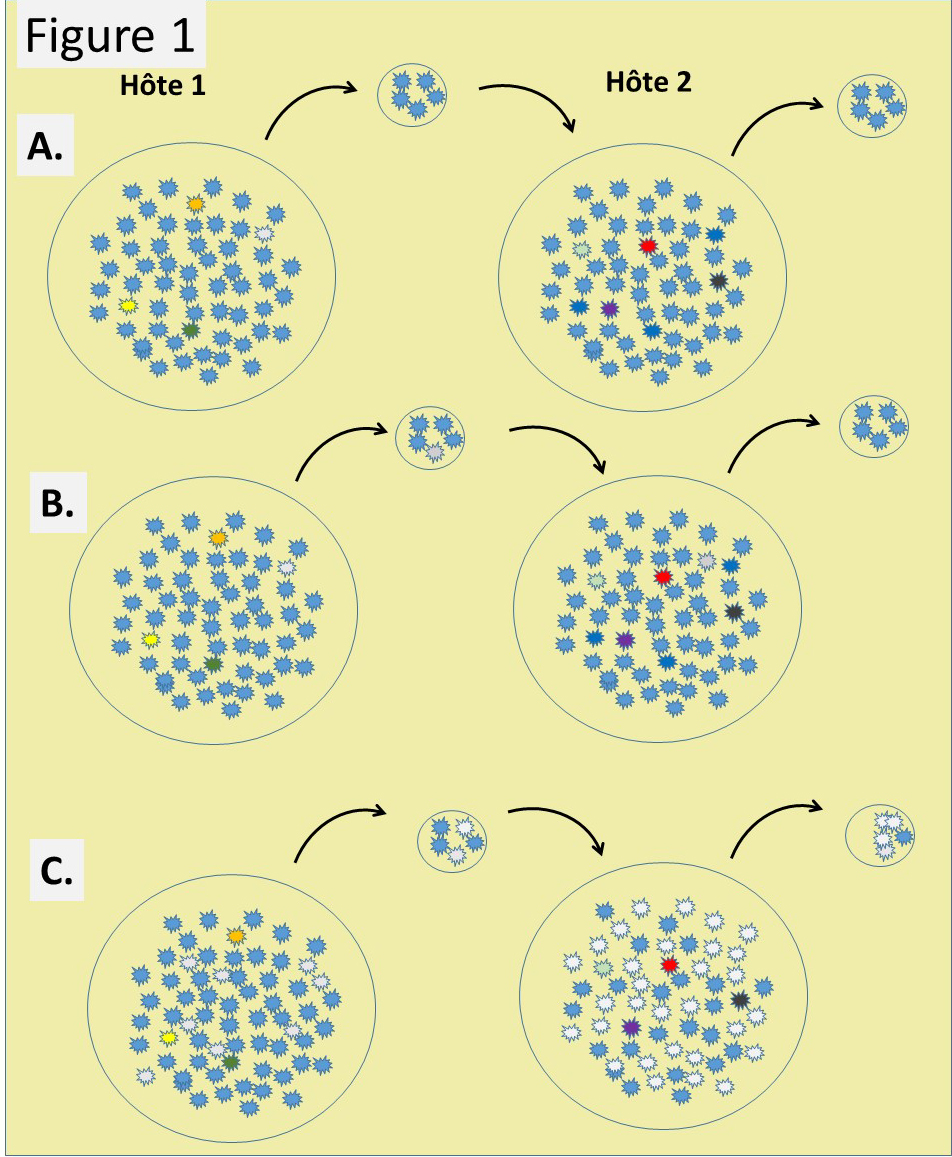
Ces opérations « photocopie » dans deux sites distincts s’apparentent à la situation d’une infection virale qui se déroule dans un premier hôte, qui la transmet à un deuxième. Dans la Figure 1 cette opération est décrite avec différentes particularités:
- A. Ce scénario présente une scène classique d’une quasi-espèce dans un hôte infecté par le virus bleu (Hôte 1). La multiplication de ce virus a généré à une fréquence faible (1/10’000) des variants qui accompagnent les virus bleus, l’espèce majoritaire la mieux adaptée à ce type d’hôte. Lors de la transmission de ces virus à un nouvel hôte, un échantillon réduit de virus présents dans Hôte 1 passe à Hôte 2. Cet échantillon peut très bien ne contenir aucun représentant de l’espèce minoritaire, qui, dans ces conditions, disparaissent avec la guérison (ou le décès) de Hôte 1. Dans Hôte 2, la multiplication génère une nouvelle quasi-espèce, majoritairement semblable à celle de Hôte 1, mais contenant des espèces minoritaires différentes générées au hasard de la multiplication virale dans Hôte 2. Un tel scénario peut continuer dans une relation équilibrée hôte-virus.
- B. Ce scénario diffère de A. dans le fait que lors de la transmission à Hôte 2, un virus minoritaire (virus gris) est transmis, ce qui est peu probable, mais pas impossible. Cette transmission vient dès le départ peupler les espèces minoritaires d’un variant pré-existant, ce qui détermine en partie la composition des minoritaires dans Hôte 2. Ce variant pré-existant, peut très bien ne pas être transmis plus loin si bien que dans Hôte 3 (non montré) on se retrouve dans la situation A. Il peut également accumuler de nouvelles mutations qui pourraient lui donner des propriétés nouvelles. Jusqu’à présent, les variants générés sont dits neutres. Ils n’affichent pas de propriétés particulières hormis celles de se multiplier. Ce faisant ils augmentent leur nombre, mais leur proportion en regard de l’espèce dominante, dont le nombre augmente également, ne change pas. On ne parle pas de variants dont la mutation a diminué leur capacité à se multiplier. Ceux-là s’éteignent sans faire d’histoire.
- C. Dans ce scénario, le variant gris acquière par sa mutation une propriété nouvelle qui lui donne un avantage de multiplication sur l’espèce dominante. Au cours de l’infection, grâce à cette propriété, sa représentation augmente, augmentant la probabilité de sa transmission à Hôte 2, dans lequel son avantage sélectif est en passe de l’établir comme espèce dominante. Si ce n’est pas dans Hôte 2, ce sera dans Hôte 3 (non montré). Un variant est né. Dans cet exemple l’avantage sélectif réside dans un plus de multiplication, mais ce peut très bien être un avantage lors de la transmission à un nouvel hôte, un avantage dans la capacité à échapper aux réponses de défenses de l’hôte etc.
Dans ces exemples, l’espèce d’hôte reste le même. On peut appliquer la même logique en introduisant un changement d’hôte, si d’aventure la disponibilité d’un nouvel hôte coïncide avec un la génération d’un variant ayant acquis la propriété de l’infecter. Juste pour le fun et pour se faire peur. H5N1 est un virus de la grippe aviaire inoffensif chez les oies sauvages. Transmis accidentellement à l’homme, il provoque une mortalité de 60%. Par chance, il reste un virus aviaire et ne se transmet pas d’homme à homme. Il est à parier que le variant capable de le faire a été produit à de multiples reprises dans les quasi-espèces qui infectent les oies. Comme un tel variant a peu de chance de se transmettre entre les oies, puisqu’il a acquis la propriété de se transmettre d’homme à homme, il va disparaître rapidement dans la population d’oies sauvages. Ce ne serait que la rencontre fortuite de l’oie porteuse du variant et d’un membre de l’espèce humaine qui permettrait son émergence dans la population humaine. Ouf ! Oui, une affaire de ouf. Surtout si l’on ajoute que H5N1 se transmet efficacement aux poulets et que les occasions de rencontres entre poulets infectés, chez qui le variant aurait été généré, et l’homme sont, dans les élevages industriels, bien plus élevées que la rencontre entre un humain et une oie sauvage. Fermons (pour l’instant) la parenthèse.
Dans la pandémie qui nous préoccupe que peut-on attendre comme variants émergents. Des variants qui se transmettent plus efficacement ? Cela semble établi. Des variants plus virulents ? Pas impossible, mais pas si sûr. Des variants qui vont échapper à l’immunité générée par la vaccination ? Très certainement. Cela pourrait dépendre du type de vaccins et des « degrés de liberté » des protéines virales.
Les variants dont la transmission est améliorée existent, sans qu’on en comprenne encore pleinement la raison. Se multiplient-ils plus efficacement dans les cellules de l’hôte infecté ? Produisent-ils plus de particules virales dans l’épithélium respiratoire ? Sont-ils plus stables dans l’environnement de contagion ? Affichent-ils une affinité plus marquée pour le récepteur sur la surface des cellules cibles ? Développent-ils plus efficacement la gymnastique moléculaire impliquée dans le processus d’injection du génome virale dans la cellule ? Toutes ces questions sont intéressantes pour les chercheurs. Les réponses pourraient aider à trouver des angles de défense, comme on dit des angles d’attaque.
Des variants plus virulents ? Déjà une transmission améliorée aboutissant à une propagation plus efficace dans la population constitue en soi un facteur de virulence augmenté : plus de personnes infectées, plus de maladies graves, plus de mortalité. Quant à l’émergence d’un variant qui, en soi, provoquerait plus de maladies graves pour des catégories de personnes chez qui la maladie était asymptomatique, c’est possible. Mais la propagation d’un tel virus pourrait ne pas être optimale. Un raisonnement à contrario peut servir à en expliquer le pourquoi. La propagation du virus est optimale lorsqu’il passe inaperçu. Pour s’en convaincre, il n’y a qu’à considérer le problème posé par tous ces infectés asymptomatiques que l’on voudrait ardemment identifier en faisant des tests à tout va. Un virus plus virulent attirerait plus l’attention et des mesures d’isolement plus strictes seraient adoptées. Avec le temps, un virus qui s’installe dans son espèce tend vers une cohabitation sans éclats. On en veut pour preuve la prévalence incroyablement élevée des virus herpétiques dans la population humaine. Quatre-vingt à cent pour cent des adultes de la planète sont infectés et porteurs de ces virus. Les infections des enfants sont pour la plupart asymptomatiques et en regard du nombre d’infectés, ces virus ne posent problèmes (parfois importants) que dans un nombre très limité de cas. Mais une cohabitation aussi sereine se construit sur une échelle de temps qui se mesure en siècles voir en millénaires.
Des variants qui échappent à l’immunité acquise après infection ou vaccination sont inhérents à la relation virus-hôte. Plus cette immunité est présente dans la population et plus la pression de sélection pour un variant qui échappe à cette restriction sera élevée. Ici, c’est un changement d’environnement pour le virus dont il est question et c’est la situation où la quasi-espèce exprime tout son potentiel. La sélection d’un tel variant est d’autant facilitée que la cible de l’immunité est restreinte.
La Figure 2 tente d’illustrer cette situation. En A, est présentée la protéine S dont le rôle est crucial pour le processus d’infection. Un domaine restreint de S à son sommet (le nez de S) se lie de manière sélective à un domaine restreint de ACE2, la protéine cellulaire. La liaison est présentée comme un emboitement du domaine de liaison de S dans une poche de ACE2. En B, un anticorps a été produit qui reconnait un domaine de S voisin du site de liaison (petit rond brun). En se liant à S, cet anticorps recouvre également le domaine de liaison de S et ce faisant empêche la liaison, le virus est neutralisé. Le variant qui échappe à cet anticorps verrait une mutation intervenir dans le domaine de S liant l’anticorps (rond rouge en C), annulant sa liaison à S, et permettant de nouveau la liaison S-ACE2. L’anticorps représenté ici est dit monoclonal. Il été produit en laboratoire pour ne contenir qu’une panoplie du même anticorps. Cette préparation d’anticorps peut représenter un médicament efficace, et c’est vraisemblablement avec ce type de médicament que Donald Trump a été traité. Mais il suffit généralement d’une mutation sur la protéine cible pour éliminer l’effet neutralisant.
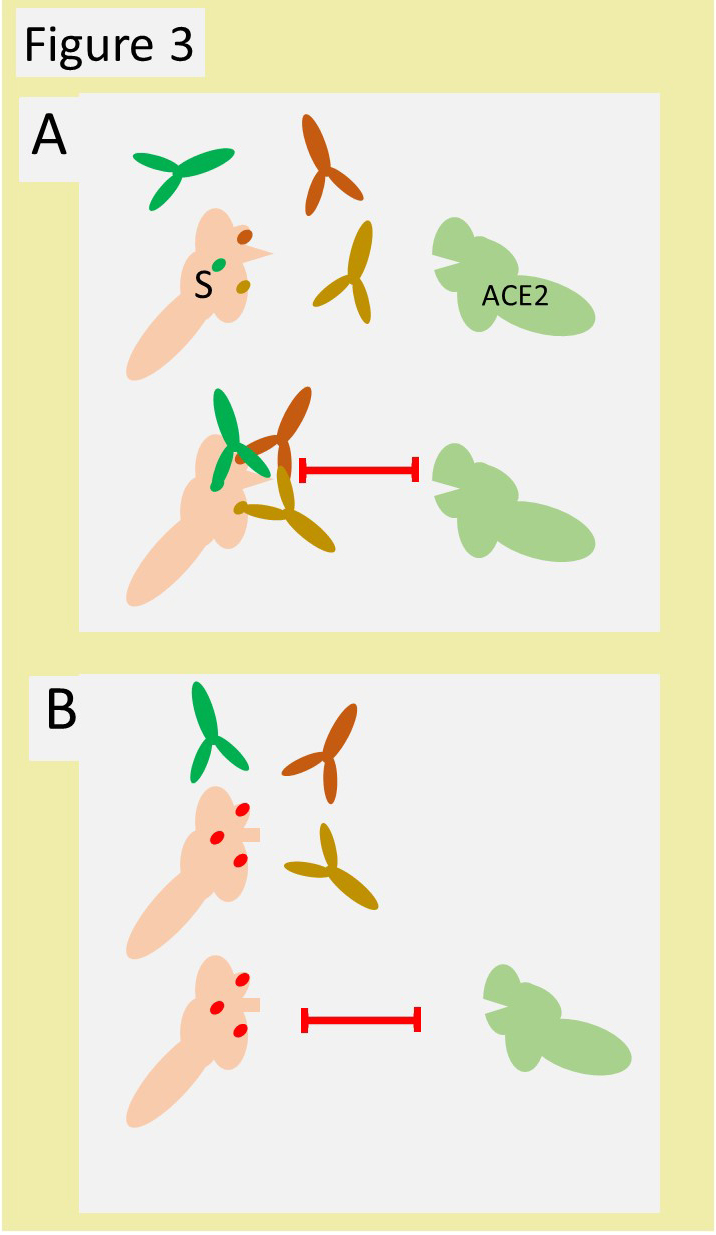
En réalité, après infection, ou après vaccination, les anticorps produits représentent un mélange d’anticorps, ayant chacun la propriété de se lier à des domaines différents de la S (Figure 3A).
Ils sont dits poly clonaux. Ils forment un réseau sur la protéine cible, neutralisant son activité avec plus de sécurité. Un variant qui échapperait à cette neutralisation impliquerait la survenue de plusieurs mutations annulant la liaison avec plusieurs anticorps. La probabilité de cette survenue est infiniment plus faible. L’autre facteur à prendre en compte (Figure 3B) est la nécessité pour le virus de conserver la fonction de S, sa capacité à lier ACE2. C’est ici qu’intervient le « degré de liberté » de la protéine. Pour qu’un variant échappant à la neutralisation émerge, il ne faut pas que les mutations, qui annuleraient la liaison de S avec ses anticorps, annulent également la liaison à ACE2 en modifiant le site de liaison de S (le nez pointu de S a été changé en petit rectangle). Un tel mutant n’est pas viable. La nécessité de conserver la fonction de la protéine S (attachement à ACE2) limite ainsi l’émergence de variants qui échapperaient à la neutralisation par des anticorps poly clonaux.
Une telle contrainte sur l’apparition de variants est connue depuis les années 1960, lors de l’introduction des vaccins contre le virus de rougeole. Il est reconnu que ce virus à ARN subit des mutations au taux habituel pour ce type de virus. Pourtant, malgré une immunité très élevée dans la population mondiale, le vaccin reste toujours efficace. On interprète cette observation comme la démonstration que les mutations qui annuleraient sa liaison aux anticorps produits après vaccination (ou après avoir fait une rougeole) détruiraient la capacité de la protéine de surface du virus à s’attacher aux récepteurs cellulaires. Le virus de la rougeole se distingue en cela des virus de la grippe qui voient leurs protéines de surface dériver année après année, nécessitant une adaptation des vaccins. Le SARS-CoV-2 sera-t-il plus « grippeux » que « rougeoleux », difficile à le prédire. La réponse est inscrite dans la boule de cristal que d’aucuns voudraient voir utiliser par nos autorités sanitaires pour « établir des perspectives de retour à la normale ».
Une dernière remarque pour terminer. Si les mutations sont vues comme une stratégie efficace développée par les virus pour s’adapter de la meilleure façon à l’environnement dans lequel ils évoluent, lorsqu’elles s’accumulent elles deviennent un élément à forte probabilité de diminuer la capacité du virus à survivre. Un exemple éloquent est donné par le virus VIH qui a évolué pour résister à trois médicaments simultanés (tri-thérapie). L’accumulation de ces mutations peut parfois résulter en un virus « boiteux » dont la virulence est grandement diminuée, au point où il peut maintenant être toléré, sans changement d’approche thérapeutique. Même pour les virus, le mieux peut être l’ennemi du bien.