 En 2006, des vaccins ont été rendus disponibles pour se prémunir contre les effets délétères des infections par les Papilloma virus, une famille de virus comprenant plus d’une centaine de types différents. Parmi cette multitude de virus, qui sont pour la plupart responsables du développement de verrues banales et passagères, certains types sont connus pour déclencher à fréquence élevée des cancers des organes génitaux de la femme, mais pas que (pour une présentation plus détaillée de ces virus cf. Se vacciner pour prévenir le cancer…..). L’idée ici était donc développer des vaccins qui préviendraient l’infection de ces virus et de vacciner les jeunes filles avant qu’elles ne soient sexuellement actives, les virus se transmettant essentiellement lors de rapports sexuels. Comme les lésions cancéreuses se développent après une persistance virale de plusieurs années, il était nécessaire d’attendre avant de pouvoir faire le bilan des campagnes de vaccinations qui ont été initiées à partir de cette époque.
En 2006, des vaccins ont été rendus disponibles pour se prémunir contre les effets délétères des infections par les Papilloma virus, une famille de virus comprenant plus d’une centaine de types différents. Parmi cette multitude de virus, qui sont pour la plupart responsables du développement de verrues banales et passagères, certains types sont connus pour déclencher à fréquence élevée des cancers des organes génitaux de la femme, mais pas que (pour une présentation plus détaillée de ces virus cf. Se vacciner pour prévenir le cancer…..). L’idée ici était donc développer des vaccins qui préviendraient l’infection de ces virus et de vacciner les jeunes filles avant qu’elles ne soient sexuellement actives, les virus se transmettant essentiellement lors de rapports sexuels. Comme les lésions cancéreuses se développent après une persistance virale de plusieurs années, il était nécessaire d’attendre avant de pouvoir faire le bilan des campagnes de vaccinations qui ont été initiées à partir de cette époque.
Dès le début, des études à échelles locales, voire nationales ont foisonné, avec toutefois toujours l’incertitude de la latence nécessaire pour objectiver les effets des vaccinations, ceci d’autant, qu’en parallèle, la détection des lésions précancéreuses par frottis (Pap test) a été appliquée avec une fréquence et une régularité de plus en plus élevées. Autre élément de complexité, la disponibilité de vaccins ciblant de plus en plus de types de virus, après que les premiers signes du succès des vaccins initiaux ont commencé à paraître. D’un vaccin ciblant les deux types les plus virulents (type 16 et 18), on est passé à des vaccins quadrivalents (4 types), heptavalents (7 types) et même nonavalents (9 types). Finalement, une attention particulière est donnée à l’âge des personnes vaccinées et à leur statut virologique au moment de la vaccination, c’est-à-dire contrôlées pour être libres ou non de tous les HPV à haut risque (hrHPV), incluant bien sûr HPV16 et 18.
Parmi, les centaines d’articles publiés ou non, un document de 2018 émanant de la Cochrane Library fait la synthèse de 26 études émanant, pour la plupart, de firmes pharmaceutiques (sic) produisant les vaccins et impliquant 73’428 adolescentes et femmes dont la majorité avait moins de 26 ans. Trois études concernaient pourtant des femmes de 25 à 45 ans. Toutes les études évaluent la sécurité des vaccins sur une période de 0.5 à 7 ans et la protection contre l’apparition des lésions précancéreuses sur une période de 3.5 à 8 ans. Cette synthèse se focalise sur les risques de développer des lésions précancéreuses suite à l’infection par les deux types de HPV 16 et 18, responsables de plus de 70% des cancers du col de l’utérus.
Pour les femmes de moins de 15-25 ans, libres de toute infection par hrHPV au moment de la vaccination, le risque de lésions précancéreuses du col de l’utérus associées aux HPV 16 et 18 passe de 164 à 2/10’000. La vaccination réduit en plus le risque d’apparition de toute lésion précancéreuse (produite par d’autres type de HPV) de 287à 106/10’000.
Cette protection varie selon les groupes d’âge. Si pour les femmes plus jeunes contrôlées libres d’infection par HPV 16 et 18 au moment de la vaccination, le risque de développer des lésions précancéreuses passe de 113 à 6/10’000, pour les femmes de 25 ans et plus, ce risque passe de 45 à 14/10’000.
Si l’on prend en compte toutes les femmes, indépendamment de leur statut virologique au moment de la vaccination, celles vaccinées entre 15 et 26 ans voient le risque de lésions précancéreuses dues à HPV 16 et 18 passer de 341 à 157/10’000, et le risque de développer toute autre lésion précancéreuse passer de 550 à 391/10’000. Pour celles vaccinées entre 25 et 45 ans, la réduction de ce risque est plus faible, passant de 145 à 107/10’000 pour les lésions dues à HPV 16 et 18. Ici le risque de développer toute autre lésion précancéreuse ne varie pas entre vaccinées et non vaccinées, 343 versus 356/10’000. Ceci est vraisemblablement dû à une forte prévalence d’infections avant vaccination.
L’analyse publiée par la Cochrane Library conclut de plus que des effets indésirables de la vaccination n’ont pas été mis en évidence. Le taux de mortalité est similaire 11/10’000 versus 14/10’000, bien qu’il semble que le taux de mortalité soit plus important pour des femmes plus âgées dans le lot de personnes vaccinées.
En regard de la grossesse, la vaccination n’augmente pas le taux de fausse couche ou de naissance précoce. Les données ne sont pas suffisantes pour tirer des conclusions définitives sur le taux de mortinatalité ou le risque d’enfants malformés.
Un étude récente publiée début octobre 2020 vient corroborer les conclusions de la méta analyse citée ci-dessus. Cette étude suédoise a suivi une population de 1,672,983 jeunes filles et femmes âgées de 10 à 30 ans de 2006 à 2017 dont 527,871 ont reçu au moins une dose de vaccin dans la période du suivi. Le cancer du col de l’utérus a été diagnostiqué chez 19 femmes ayant reçu le vaccin tétravalent contre 538 femmes qui n’avaient pas été vaccinées. (NEJM).
Ces résultats sont spectaculaires. Cet effet est si significatif que l’on a pu mesurer, dans certains cas, un effet d’immunité de groupe venant d’une diminution de circulation de virus dans la population. Une autre conclusion s’impose, celle de ne pas se cantonner à la vaccination des filles, mais également celle des garçons. Ces derniers participent bien sûr à la chaîne de transmission hétérosexuelle. De plus, il s’avère qu’il faut également protéger les hommes qui ont des rapports sexuels avec les hommes. Ces derniers souffrent de lésions anales, du pénis et l’oropharynx, et les indications existent maintenant que leur vaccination leur est profitable. Finalement, la leçon à tirer de ces études est que plus la vaccination arrive tôt, meilleure est l’effet protecteur.
Les vaccins sont issus de la technologie du génie génétique et contiennent tous un seul composant (voire une partie de composant) des virus qu’ils ciblent : une protéine de surface L1 impliquée dans la fixation du virus sur la cellule à infecter, neutralisant ainsi l’infection. Ce qui ne ressort pas encore de façon claire, et pour cause, c’est la durée de protection que confère une immunisation. La protection va-t-elle durer toute la vie, comme c’est le cas de la vaccination contre le virus de la rougeole, ou va-t-il falloir faire des rappels, comme pour les virus de l’hépatite A ou de la rage. De plus, dans la mesure où les virus Papilloma humains ont comme seul hôte l’espèce humaine, on peut envisager à terme leur éradication, comme cela a été le cas pour le virus de la variole. Rappelons que l’éradication des virus de la poliomyélite reste un objectif brûlant de l’Organisation Mondiale de la Santé (OMS). Un objectif contrecarré par les difficultés à atteindre les dernières populations susceptibles dans quelques endroits du globe, ceci pour des raisons idéologiques ou de conflits armés.
En conclusion, les résultats de la vaccination contre les virus Papilloma, viennent nous rappeler que la vaccination reste une des plus extraordinaires révolutions médicales, n’en déplaise aux lobbies anti-vaccins qui devraient peut-être se pencher sur les simples graphiques montrant l’évolution des épidémies virales avant et après la disponibilité de vaccins . Pour mémoire, le graphique ci-dessous montre l’exemple de l’incidence des cas de poliomyélites aux USA, après l’introduction des vaccins dans les années 1950. 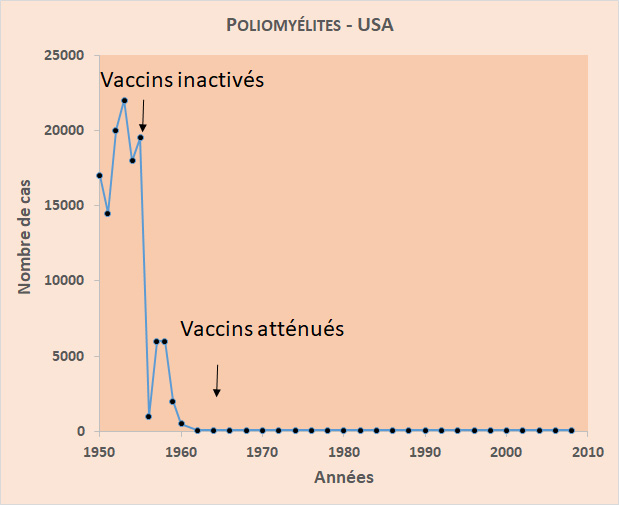
Mais ce n’est pas de raison qu’il est question dans cette affaire, paraît-il….
NB1. Arbyn_et_al-2018-Cochrane_Database_of_Systematic_Reviews
NB2. Pour une mise à jour de la situation en Suisse: hpv-impfung-wirksam-sicher-fr
Màj 03.11.2020