Partager la publication "Le virus de la variole du singe ou l’orthopoxvirose simienne (sic…)"
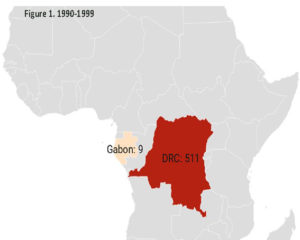
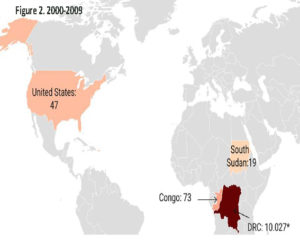
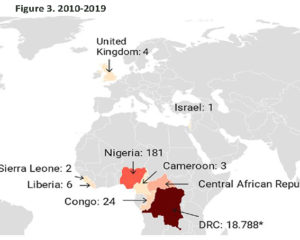
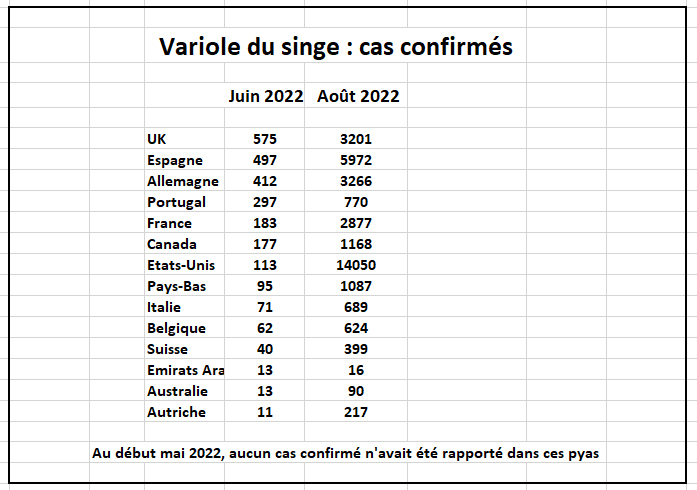
 Historique. La variole du singe est une maladie causée par le virus du même nom. Ce virus a été découvert en 1958 suite à une épidémie survenue chez des singes de laboratoire au Danemark. Le premier cas humain a été décrit en 1970 au Zaïre (actuellement la République Démocratique du Congo, RDC) chez un enfant de neuf mois, lors de l’intense campagne de vaccination visant à l’élimination de la variole humaine. De la RDC le virus s’est répandu dans les pays de l’Afrique de l’ouest. Il fait une incursion maitrisée aux Etats-Unis en 2003 et atteint l’Europe durant la dernière décennie (cf. Figures 1-3). Au 26 mai 2022, près de 600 cas humains ont été rapportés dans près de 20 pays d’Europe, aux États-Unis et en l’Australie. En Suisse, au 7 juin, 10 cas ont été confirmés (OFSP).
Historique. La variole du singe est une maladie causée par le virus du même nom. Ce virus a été découvert en 1958 suite à une épidémie survenue chez des singes de laboratoire au Danemark. Le premier cas humain a été décrit en 1970 au Zaïre (actuellement la République Démocratique du Congo, RDC) chez un enfant de neuf mois, lors de l’intense campagne de vaccination visant à l’élimination de la variole humaine. De la RDC le virus s’est répandu dans les pays de l’Afrique de l’ouest. Il fait une incursion maitrisée aux Etats-Unis en 2003 et atteint l’Europe durant la dernière décennie (cf. Figures 1-3). Au 26 mai 2022, près de 600 cas humains ont été rapportés dans près de 20 pays d’Europe, aux États-Unis et en l’Australie. En Suisse, au 7 juin, 10 cas ont été confirmés (OFSP).
Légende des figures : Les chiffres indiqués en regard des pays se réfèrent aux nombres de cas détectés durant la décennie.
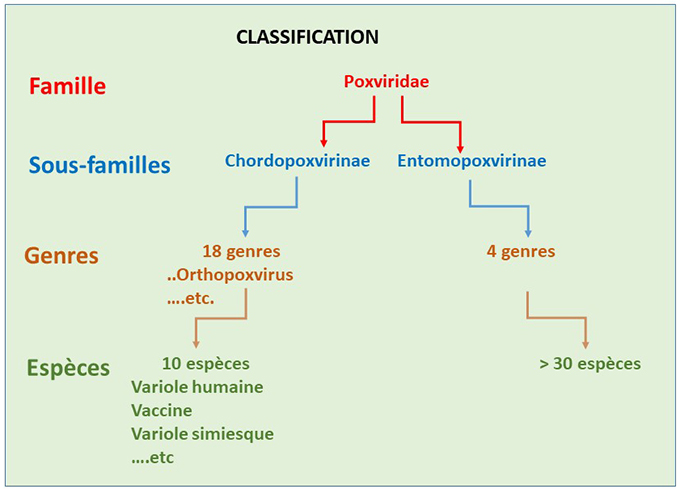
Classification. Le virus de la variole simienne fait partie de la grande famille des Poxviridae, qui comprend deux sous-familles, les Chordopoxvirinae et les Entomopoxvirinae, infectant, respectivement, les vertébrés et les invertébrés. Les Chordopoxvirinae se subdivisent en 18 genres différents, parmi lesquels les Orthopoxvirus qui comprennent 10 espèces différentes. Parmi ces espèces, on trouve, entre autres, le virus de la variole humaine, le virus de la vaccine (qui a servi de vaccin contre le virus de la variole humaine) et le virus de la variole simienne qui nous intéresse ici (cf. Classification).
Le virus. La particule virale vue au microscope électronique a une forme ovoïde, avec à l’intérieur un noyau en forme d’haltère (Figue 4). On voit à la périphérie la membrane graisseuse bicouche, crénelée par les protéines de surface qui y sont ancrées. Cette image montre un virus dit mature (MV). Une autre forme, dite extracellulaire (EV, non montrée), voit la MV entourée d’une deuxième membrane externe, créant des particules plus stables dans le milieu extracellulaire, favorisant l’infection de cellules distantes. On trouve également des MV contenant deux doubles membranes externes appelés « virus enrobés » (en anglais « wrapped virus », WR), aux pouvoirs de propagation encore augmentés.
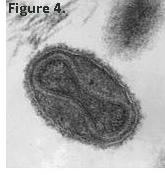 Le noyau interne en forme d’haltère apparait bordé de deux membranes bicouches. Il contient le génome viral composé d’ADN double brin. La taille du génome varie pour les différents Poxviridae entre 140’000-340’000 paires de nucléotides. Le génome du virus simien en compte environ 190’000. Cette taille de génome permet la synthèse de plus de 200 protéines donnant au virus une grande autonomie dans sa capacité de multiplication. Pour comparaison, le SARS CoV 2, avec ses 30’000 nucléotides, ne promeut la synthèse que de quelques 20 protéines. Cette autonomie permet au virus de faire sa multiplication de manière quasi autonome dans le cytoplasme de la cellule, il n’a besoin que de la machinerie de synthèse des protéines. Il créée de ce fait une zone de « fabrique virale » dans laquelle se déroulent toutes les étapes qui mènent à la production de nouvelles particules. Le virus est peu dépendant du contexte cellulaire. La limite à l’infection vient vraisemblablement d’une restriction à l’entrée du virus dans les cellules, orchestrée par des protéines réceptrices qui n’ont pour l’instant pas été identifiées avec certitude.
Le noyau interne en forme d’haltère apparait bordé de deux membranes bicouches. Il contient le génome viral composé d’ADN double brin. La taille du génome varie pour les différents Poxviridae entre 140’000-340’000 paires de nucléotides. Le génome du virus simien en compte environ 190’000. Cette taille de génome permet la synthèse de plus de 200 protéines donnant au virus une grande autonomie dans sa capacité de multiplication. Pour comparaison, le SARS CoV 2, avec ses 30’000 nucléotides, ne promeut la synthèse que de quelques 20 protéines. Cette autonomie permet au virus de faire sa multiplication de manière quasi autonome dans le cytoplasme de la cellule, il n’a besoin que de la machinerie de synthèse des protéines. Il créée de ce fait une zone de « fabrique virale » dans laquelle se déroulent toutes les étapes qui mènent à la production de nouvelles particules. Le virus est peu dépendant du contexte cellulaire. La limite à l’infection vient vraisemblablement d’une restriction à l’entrée du virus dans les cellules, orchestrée par des protéines réceptrices qui n’ont pour l’instant pas été identifiées avec certitude.
Transmission. Le virus a principalement deux voies d’entrée dans l’organisme. Le contact direct de la peau ou des muqueuses (yeux, nez, bouche, muqueuses génitales) avec le virus qui se trouve en nombre dans le liquide des pustules, dans le sang ou des sécrétions qui souillent les surfaces ou les habits. Les cellules de l’épiderme sont alors infectées. L’absorption de gouttelettes contaminées dans les voies respiratoires constitue la deuxième voie. Ici ce sont les macrophages alvéolaires qui sont infectés en première ligne.
L’infection. Une première propagation virale se fait par le sang (virémie) qui résulte dans l’infection de la rate, du foie et de la moelle osseuse. S’ensuit une deuxième virémie qui disperse le virus vers la périphérie avec atteinte des cellules de la peau et des muqueuses. Se développe dès lors une éruption généralisée de pustules qui avant qu’elles ne deviennent croutées produisent un liquide hautement contagieux.
La maladie. Contrairement à l’infection par les Coronavirus, l’infection par les Poxvirus est presque toujours symptomatique avec cette éruption de pustules. Pourtant l’éruption ne se manifeste qu’après 12 jours d’incubation en moyenne. L’éruption peut durer de 12 jours à un mois. Les premiers symptômes correspondent à ceux d’une infection non spécifique : fièvre, maux de tête, douleurs dorsales, grande fatigue. Un gonflement prononcé des ganglions de la zone faciale et des ganglions inguinaux ont servi par le passé à distinguer la variole simienne de la variole humaine. Dans les années 1970-1989, la variole simienne était principalement une maladie de jeunes enfants (4-5 ans). L’âge moyen a augmenté à 10 ans dans les années 2000-2009 et a atteint 21 ans pour les années 2010-2019. Cette évolution est vraisemblablement liée à l’arrêt de la vaccination contre la variole humaine (voir ci-dessous : Lutte antivirale).
Mortalité. Une publication récente (février 2022) ** résume les données de revues ou méta-analyses accumulées sur le sujet de la variole simienne jusqu’en septembre 2020. Concernant la mortalité, plus de 40 publications ou rapports sont pris en compte. Les résultats sont disparates allant de 0% à 50% en fonction du nombre de cas rapportés. Un mort sur deux cas rapportés explique le 50%. En prenant en compte les rapports concernant des nombres de cas dépassant la vingtaine, et s’étalant sur une période de 1981 à 2019, 782 cas ont pu être répertoriés en Afrique de l’ouest (dont 489 en RDC). Le taux de mortalité pour ces cas s’élève à 8-11%. Ce chiffre concerne presque exclusivement les pays d’Afrique de l’Ouest. Il est considérablement plus élevé que celui articulé actuellement concernant les pays d’Europe et les États-Unis, où les cas ne sont encore qu’anecdotiques. Pour les années 1970-2000, 100% de la mortalité concernait des enfants de moins de 10 ans, alors que pour les années 2000-2019, cette catégorie d’âge ne représente plus que 38% (cf. ci-dessous)
Lutte antivirale. Il n’existe pas de vaccin contre le virus de la variole simienne. Il y a des indications, en revanche, que la vaccination contre la variole humaine affiche des effets protecteurs. Par exemple, dans la publication citée ci-dessus il est noté que 80-96 % des cas de variole simienne concernent des personnes non-vaccinées contre la variole humaine. Également l’évolution de l’âge moyen des personnes infectées entre 1970 et 2019 est en corrélation avec l’avancée en âge de personnes qui n’ont pas reçu la vaccination contre la variole humaine qui a été arrêtée au début des années 1980 (voir ci-dessus: La maladie). Deux médicaments antiviraux existent qui interviennent sur le cycle de multiplication du virus. Le Cidofovir bloque la réplication de l’ADN viral. Il est déjà utilisé en pommade pour traiter les infections cutanées dues aux virus Papilloma et Herpès. Ce médicament est disponible en Suisse. Le Tecovirimat, lui, intervient en annulant la fonction des protéines virales qui participent à l’enveloppement des particules virales dans des membranes lipidiques. Il réduit de ce fait la capacité de propagation du virus lors de l’infection. Ce médicament est disponible en Suisse de façon restreinte, mise à disposition notamment par le Centre des maladies virales émergentes des HUG pour l’instant.
En guise de conclusion (temporaire). Il est remarquable que la variole simienne s’immisce dans les préoccupations sanitaires du moment. Alors que la propagation virale reste anecdotique, le traumatisme de la pandémie COVID y est certainement pour quelque chose. Le virus est sorti d’Afrique où les contacts avec des animaux infectés sont souvent à l’origine des poches d’infection. C’est presque toujours le cas lorsque le nombre d’humains infectés est faible. Lorsque l’on dépasse la dizaine de cas, la propagation entre humains prend le relai. Dans les pays Européens et les États-Unis, ce sont des contaminations entre humains qui sont et vont être le vecteur de la propagation. Alors que la maladie, toujours symptomatique et spectaculaire, permet de circonscrire plus facilement les cas d’infections, le rôle que pourraient jouer les animaux de compagnie ne doit pas être sous-estimé. Les millions de chats et de chiens qui cohabitent étroitement avec les humains dans les pays dits développés, et qui sont des hôtes potentiels, pourraient représenter des courroies de transmission plus difficiles à maitriser, si d’aventure la propagation d’humains à humains atteignait un seuil critique. Pour l’instant l’augmentation des cas est constante.
NB: La liste n’est pas exhaustive.
Source: https://ourworldindata.org/explorers/monkeypox?facet=none&pickerSort=desc&pickerMetric=total_confirmed_by_confirmation&Metric=Confirmed+cases&Frequency=Cumulative&Shown+by=Date+of+confirmation&country=OWID_WRL~IRL~POL
MàJ 24.08.2022