 Disons d’emblée qu’il ne va s’agir ici que de virus grippaux de type A dont le réservoir majoritaire se trouve dans le monde aviaire (cf. Les pandémies de grippe Saison I et Saison II). En parallèle à cette histoire de pandémies, les virus exclusivement humains de type B circulent toujours sous forme épidémique. Ces virus ne changent pas d’identité brusquement par réassortiment.
Disons d’emblée qu’il ne va s’agir ici que de virus grippaux de type A dont le réservoir majoritaire se trouve dans le monde aviaire (cf. Les pandémies de grippe Saison I et Saison II). En parallèle à cette histoire de pandémies, les virus exclusivement humains de type B circulent toujours sous forme épidémique. Ces virus ne changent pas d’identité brusquement par réassortiment.
 La description détaillée des pandémies de grippe com-mence au début du XXème siècle avec l’émergence dans la population humaine du virus H1N1 d’origine aviaire. Nous n’avons pas d’information pour les siècles qui ont précédé puisque les virus ont été décrits à la fin du XIXème siècle seulement et les virus de la grippe isolés dans les années 1930. On est pourtant remonté aux années 1889-90, où un virus H3N8 aurait provoqué une pandémie, grâce à l’«archéo-sérologie », qui consiste à caractériser les anticorps anti-virus trouvés dans le sérum des personnes ayant vécu cet épisode. La grande figure ci-dessus présente l’image complète de ces pandémies. Dans la partie supé-rieure, les virus aviaires H1N1, H2N2 et H3N2, partenaires des pandémies sont illustrés. La partie centrale est plus complexe. Elle présente d’abord les dates de ces pandémies. A chacune des dates correspond, un nouveau virus dont la circulation peut être suivie par les flèches bleues qui décorent la bande grise interrompue par la présentation des virus. Enfin, dans la partie inférieure, la course du virus H1N1 dans le porc est indiquée. Au bas de la figure, une légende donne le sens des symboles utilisés. Chaque étape de l’histoire est reprise pour une description plus complète.
La description détaillée des pandémies de grippe com-mence au début du XXème siècle avec l’émergence dans la population humaine du virus H1N1 d’origine aviaire. Nous n’avons pas d’information pour les siècles qui ont précédé puisque les virus ont été décrits à la fin du XIXème siècle seulement et les virus de la grippe isolés dans les années 1930. On est pourtant remonté aux années 1889-90, où un virus H3N8 aurait provoqué une pandémie, grâce à l’«archéo-sérologie », qui consiste à caractériser les anticorps anti-virus trouvés dans le sérum des personnes ayant vécu cet épisode. La grande figure ci-dessus présente l’image complète de ces pandémies. Dans la partie supé-rieure, les virus aviaires H1N1, H2N2 et H3N2, partenaires des pandémies sont illustrés. La partie centrale est plus complexe. Elle présente d’abord les dates de ces pandémies. A chacune des dates correspond, un nouveau virus dont la circulation peut être suivie par les flèches bleues qui décorent la bande grise interrompue par la présentation des virus. Enfin, dans la partie inférieure, la course du virus H1N1 dans le porc est indiquée. Au bas de la figure, une légende donne le sens des symboles utilisés. Chaque étape de l’histoire est reprise pour une description plus complète.
1918 : La grippe espagnole H1N1.
 C’est la pandémie du siècle. On parle de grippe espagnole, parce que c’est d’Espagne qu’est venue l’annonce de la vague grippale. Dans les pays européens et les États-Unis, en guerre, la censure de la presse ne permettait pas de divulguer la nouvelle. L’endroit où la vague a débuté est encore sujet à débats. D’autant qu’il y en aurait eu trois. Au printemps 2018, dans un camp militaire au Kansas, une maladie respiratoire a été rapportée. Elle est très contagieuse mais avec peu de conséquences graves. Elle passe de ce fait presque inaperçue, en étant toutefois à l’origine de l’annonce faite par l’Espagne. Fin août, une nouvelle vague, avec cette fois une mortalité bien plus élevée, est signalée dans l’ouest de la France. Elle se répand en quelques semaines sur toute la planète. Un tiers de la population des États-Unis est touchée avec un taux de mortalité dépassant les 2.5% (contre 0.1% lors d’une grippe normale). Ce taux ne reflète que la situation dans les pays dits développés. Il a été bien supérieur en Afrique et en Asie, où, dans des endroits reculés, le taux de mortalité a pu s’élever à 70%. Une troisième vague, avec un agent de même virulence, a déferlé sur la planète à la fin 1918 début 1919. En plus de la capacité à provoquer des pneumonies virales foudroyantes à haute fréquence, une caractéristique de ce virus tient à la capacité à infecter en priorité des hommes jeunes entre 20-40 ans, en plus des jeunes enfants et des personnes de plus de 65 ans, qui sont des cibles habituelles. L’estimation du nombre de morts durant cette pandémie, n’a cessé d’être revue à la hausse. On parle actuellement de 40 à 50 millions de victimes sur toute la planète dans une période d’un an. Pour comparaison, on estime actuellement le nombre de victimes du virus du SIDA à plus de 30 millions, en un peu plus de trente ans.
C’est la pandémie du siècle. On parle de grippe espagnole, parce que c’est d’Espagne qu’est venue l’annonce de la vague grippale. Dans les pays européens et les États-Unis, en guerre, la censure de la presse ne permettait pas de divulguer la nouvelle. L’endroit où la vague a débuté est encore sujet à débats. D’autant qu’il y en aurait eu trois. Au printemps 2018, dans un camp militaire au Kansas, une maladie respiratoire a été rapportée. Elle est très contagieuse mais avec peu de conséquences graves. Elle passe de ce fait presque inaperçue, en étant toutefois à l’origine de l’annonce faite par l’Espagne. Fin août, une nouvelle vague, avec cette fois une mortalité bien plus élevée, est signalée dans l’ouest de la France. Elle se répand en quelques semaines sur toute la planète. Un tiers de la population des États-Unis est touchée avec un taux de mortalité dépassant les 2.5% (contre 0.1% lors d’une grippe normale). Ce taux ne reflète que la situation dans les pays dits développés. Il a été bien supérieur en Afrique et en Asie, où, dans des endroits reculés, le taux de mortalité a pu s’élever à 70%. Une troisième vague, avec un agent de même virulence, a déferlé sur la planète à la fin 1918 début 1919. En plus de la capacité à provoquer des pneumonies virales foudroyantes à haute fréquence, une caractéristique de ce virus tient à la capacité à infecter en priorité des hommes jeunes entre 20-40 ans, en plus des jeunes enfants et des personnes de plus de 65 ans, qui sont des cibles habituelles. L’estimation du nombre de morts durant cette pandémie, n’a cessé d’être revue à la hausse. On parle actuellement de 40 à 50 millions de victimes sur toute la planète dans une période d’un an. Pour comparaison, on estime actuellement le nombre de victimes du virus du SIDA à plus de 30 millions, en un peu plus de trente ans.
Le virus H1N1 est proposé venir, en bloc, du monde aviaire. Il a dû circuler précédemment à bas bruit dans ou autour de la population humaine (le porc ?) pour acquérir la capacité à reconnaître le récepteur humain et de se transmettre d’hu-main à humain. Après la pandémie, H1N1 s’est établi dans la population humaine, faisant des épidémies année après année. Durant cette période le virus a évolué comme attendu vers moins de virulence par vertu, entre autre, d’une immunité croissante dans la population. Cette immunité a provoqué également une évolution progressive (glissements) des protéines H1 et N1 (symbolisée dans la figure par le passage d’un bleu intense à un bleu pâle). A partir des années 1930, il a été possible d’isoler des virus, de les cultiver et de les conserver en laboratoire (flasque de la figure). Un tel virus, isolé dans les année 1950, va encore faire parler de lui (cf. ci-dessous).
1957 : La grippe asiatique H2N2
 L’origine de cette pandémie a été établie en Chine du sud, dans la province de Guizhou au mois de février 1957. Elle se répand dans la province du Hunan en mars et à Singapour et Hong Kong en avril. En mai, l’agent causal a été isolé au Japon comme un virus H2N2. Une pre-mière vague a atteint les États-Unis et le Royaume-Uni en octobre, suivie d’une deuxième vague en janvier 1958. Les jeunes de 5 à 19 ans sont les plus atteints avec un taux d’infection de près de 50%. On estime à 1 million le nombre de morts sur toute la planète.
L’origine de cette pandémie a été établie en Chine du sud, dans la province de Guizhou au mois de février 1957. Elle se répand dans la province du Hunan en mars et à Singapour et Hong Kong en avril. En mai, l’agent causal a été isolé au Japon comme un virus H2N2. Une pre-mière vague a atteint les États-Unis et le Royaume-Uni en octobre, suivie d’une deuxième vague en janvier 1958. Les jeunes de 5 à 19 ans sont les plus atteints avec un taux d’infection de près de 50%. On estime à 1 million le nombre de morts sur toute la planète.
H2N2 est le résultat d’un réassortiment entre le virus H1N1 et un virus H2N2 aviaire. Trois segments du génome de H1N1 ont été remplacés par les trois segments corres-pondant du virus H2N2, dont les 2 permettant la production de HA et de NA. Ce virus humain présente donc à sa surface l’identité du virus H2N2 aviaire. Une telle identité est inconnue dans la population humaine, qui se trouve ainsi sans protection préalable. Ce virus humain H2N2 déplace le virus H1N1 qui disparait de la circulation. Les épidémies annuelles ne montrent dès lors plus que le virus H2N2 (accompagné toujours par le virus de type B). La dispo-nibilité de vaccins dès le mitant des années 1960 va concourir à tempérer la circulation de ce virus.
1968 : La Grippe de Hong Kong, H3N2
 Les premiers signes d’une nouvelle pandémie apparaissent en Asie durant l’été 1968. En juillet, un virus caractérisé comme H3N2 est isolé à Hong Kong. Ce virus se répand rapidement sur toute la planète. Le taux d’infection le plus élevé, de près de 40%, se retrouve chez des jeune de 10-14 ans. Une mortalité excédentaire de 38’000 personnes est estimée aux États-Unis.
Les premiers signes d’une nouvelle pandémie apparaissent en Asie durant l’été 1968. En juillet, un virus caractérisé comme H3N2 est isolé à Hong Kong. Ce virus se répand rapidement sur toute la planète. Le taux d’infection le plus élevé, de près de 40%, se retrouve chez des jeune de 10-14 ans. Une mortalité excédentaire de 38’000 personnes est estimée aux États-Unis.
Le virus H3N2 est le résultat d’un nouveau réassortiment avec un virus aviaire H3N? qui n’a pas été caractérisé plus en détail. Le nouveau virus humain H3N2 a reçu du virus aviaire deux segments, dont celui permettant de produire un nouvel HA. Ce H3 diffère suffisamment de H2 pour représenter une nouvelle identité dans la population humaine. En revanche la conservation de l’autre protéine de surface N2 a tempéré la nouveauté du virus qui affiche une identité partielle avec celle de H2N2, expliquant probablement la sévérité modérée de la pandémie. Le virus H3N2 a pourtant déplacé le virus H2N2 de 1957, qui disparait des épidémies annuelles suivantes.
1977 : La grippe russe ou H1N1, le retour.
 En mai 1977, les premiers signes d’une vague de grippe par un nouveau virus apparaissent en Chine. En novembre elle s’étend aux pays de l’Union- Soviétique et atteint les États-Unis à la mi-janvier 1978. L’hiver suivant, elle recouvre les autres pays. Plus de 50% des enfants en âge de scolarité sont atteints. La maladie s’est en fait limitée aux personnes de moins de 25 ans, suggérant que les personnes plus âgées étaient protégées par une immunité résiduelle.
En mai 1977, les premiers signes d’une vague de grippe par un nouveau virus apparaissent en Chine. En novembre elle s’étend aux pays de l’Union- Soviétique et atteint les États-Unis à la mi-janvier 1978. L’hiver suivant, elle recouvre les autres pays. Plus de 50% des enfants en âge de scolarité sont atteints. La maladie s’est en fait limitée aux personnes de moins de 25 ans, suggérant que les personnes plus âgées étaient protégées par une immunité résiduelle.
Cette hypothèse a été confirmée lorsque l’identité du virus a été trouvée. Il s’est agi d’un virus H1N1, très proche du H1N1 qui circulait à la fin des années 1950. L’absence de mutations par rapport au virus de 1950 a exclu la possibilité que ce virus ait pu circuler dans un hôte non-humain pendant plus de 20 ans, avant de revenir dans la population humaine. On en a conclu dès lors, qu’il avait été introduit accidentellement à partir d’une souche conservée dans un laboratoire. Il est à noter que ce nouveau virus pandémique n’a pas déplacé le virus épidémique circulant, comme cela a été le cas en 1957 et 1968. Ainsi, dès 1977, deux virus de type A, H3N2 et H1N1, ont circulé en parallèle et ont été responsables des épidémies qui ont suivi.
2009 : Le H1N1pdm09
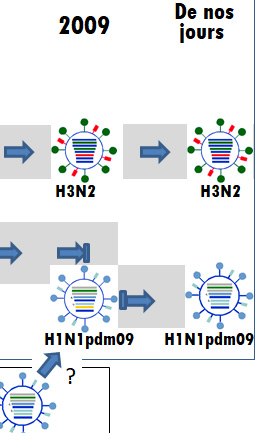 Début avril 2009 arrivent de la ville mexicaine de La Gloria (3000 habitants) des informations concernant une vague soudaine d’infections grippales affectant plus de 400 personnes (1800 ?), provoquant le mort de deux bébés. Un échantillon prélevé sur un jeune garçon de 4 ans a permis l’identification d’un même virus que celui responsable de mortalité ailleurs au Mexique. On évoque un virus porcin issu peut-être d’un élevage industriel situé à quelques kilomètres de La Gloria. Aucun porc de l’élevage ne semble pourtant affecté. A la mi-avril, plusieurs échantillons d’un agent qui s’apparente à un virus porcin H1N1 sont identifiés en Californie du Sud et au Mexique. Le virus se répand très rapidement sur tous les continents et l’OMS déclare le 12 juin l’alerte à la pandémie. Une première vague déferle sur les États-Unis en mai-juin, suivie d’une deuxième vague fin août. Pour les États-Unis, on a estimé le nombre de cas d’infections à 61 millions, provoquant 274’000 hospitalisations et 12’470 décès. De façon intéressante, cette mortalité s’est révélée après-coup inférieure à celle provoquée par les épidémies annuelles (~30’000). Toutes proportions gardées, ces statistiques correspondent à celles publiées dans les autres pays du monde (lorsqu’elles existent). Le virus, dénommé, H1N1pdm09, a déplacé le H1N1 épidémique introduit dans la population en 1977, et a provoqué moins de mortalité. Pourtant, il a ciblé une tranche de la population (5-59 ans), où les femmes enceintes, les personnes souffrant de maladies chroniques et les obèses ont payé le plus lourd tribut. Le taux d’infection des personnes âgées (> 65ans) a été moins élevé que lors des épidémies annuelles (avec en revanche un taux de mortalité plus élevé), probablement parce que cette tranche de la population affichait une immunité résiduelle venant d’infections provoquées par le H1N1 humain circulant au début des années 1950. Des vaccins ont été produits en catastrophe, qui ont généré une excellente protection après une seule dose. En résumé, après des débuts alarmants, la pandémie s’est soldée par une morbidité générale moindre que celle provoquée par les virus épidémiques, avec toutefois des cas d’infections graves, comme des pneumonies virales foudroyantes, plus fréquentes chez des personnes jeunes en bonne santé préalable. Le 10 août 2011, l’OMS déclare la fin de la pandémie.
Début avril 2009 arrivent de la ville mexicaine de La Gloria (3000 habitants) des informations concernant une vague soudaine d’infections grippales affectant plus de 400 personnes (1800 ?), provoquant le mort de deux bébés. Un échantillon prélevé sur un jeune garçon de 4 ans a permis l’identification d’un même virus que celui responsable de mortalité ailleurs au Mexique. On évoque un virus porcin issu peut-être d’un élevage industriel situé à quelques kilomètres de La Gloria. Aucun porc de l’élevage ne semble pourtant affecté. A la mi-avril, plusieurs échantillons d’un agent qui s’apparente à un virus porcin H1N1 sont identifiés en Californie du Sud et au Mexique. Le virus se répand très rapidement sur tous les continents et l’OMS déclare le 12 juin l’alerte à la pandémie. Une première vague déferle sur les États-Unis en mai-juin, suivie d’une deuxième vague fin août. Pour les États-Unis, on a estimé le nombre de cas d’infections à 61 millions, provoquant 274’000 hospitalisations et 12’470 décès. De façon intéressante, cette mortalité s’est révélée après-coup inférieure à celle provoquée par les épidémies annuelles (~30’000). Toutes proportions gardées, ces statistiques correspondent à celles publiées dans les autres pays du monde (lorsqu’elles existent). Le virus, dénommé, H1N1pdm09, a déplacé le H1N1 épidémique introduit dans la population en 1977, et a provoqué moins de mortalité. Pourtant, il a ciblé une tranche de la population (5-59 ans), où les femmes enceintes, les personnes souffrant de maladies chroniques et les obèses ont payé le plus lourd tribut. Le taux d’infection des personnes âgées (> 65ans) a été moins élevé que lors des épidémies annuelles (avec en revanche un taux de mortalité plus élevé), probablement parce que cette tranche de la population affichait une immunité résiduelle venant d’infections provoquées par le H1N1 humain circulant au début des années 1950. Des vaccins ont été produits en catastrophe, qui ont généré une excellente protection après une seule dose. En résumé, après des débuts alarmants, la pandémie s’est soldée par une morbidité générale moindre que celle provoquée par les virus épidémiques, avec toutefois des cas d’infections graves, comme des pneumonies virales foudroyantes, plus fréquentes chez des personnes jeunes en bonne santé préalable. Le 10 août 2011, l’OMS déclare la fin de la pandémie.
D’où vient ce virus et pourquoi, étant H1N1, a-t-il eu la capacité de faire une pandémie, alors qu’un H1N1 épidémique circulait dans la population depuis 1977. Les méthodes de caractérisation génétique ont permis de retracer la genèse de ce virus et révèlent un parcours étonnant, démontrant les capacités exceptionnelles d’évolution des virus de la grippe (cf. figure ci-dessus). L’histoire commence en 1918 avec le virus pandémique H1N1 qui infecte la population humaine et qui est vraisemblablement entré dans le monde porcin, pour s’y établir comme un virus porcin « classique ». Comme le virus humain, ce virus a évolué en parallèle, au cours du temps, mais avec son propre agenda et des épisodes de réassortiments qui lui sont propres. Ce H1N1 porcin rencontre un virus (PoAmNo H3N2*) issu d’un réassortiment (numéro 1) entre le virus humain H3N2 et un virus aviaire circulant en Amérique du Nord. Cette rencontre permet le réassortiment (numéro 2) qui génère un virus porcin H1N2 circulant en Amérique du Nord (PoAmNo H1N2), virus qui a ce stade a perdu son N1. PoAmNo H1N2 rencontre à son tour un virus H1N1, identifié comme circulant dans la population porcine et/ou aviaire eurasienne Eu Po-Av, H1N1. Cette rencontre permet un nouveau réassortiment (numéro 3) qui génère PoAmNo H1N1 un virus qui retrouve un N1. C’est le virus H1N1pdm09 qui émerge en 2009 au Mexique. Il faut dire pourtant qu’avant l’émergence dans la population humaine de H1N1pdm09, on n’avait pas trace de la circulation d’un virus PoAmNo H1N1 dans la population porcine. Ce qui laisse bien des questions ouvertes sur les chemins qui ont prévalu lors de la génération de H1N1pdm09.
Reste la question de comprendre pourquoi ce virus a pu déclencher une pandémie. L’évolution des HA et des NA (H et N) se fait sous la pression de l’immunité présente dans la population. Ce sont les anticorps se fixant sur HA et NA qui permettent la sélection de mutants qui échappent à cette fixation, sélection qui constitue le moteur de l’évolution du virus par glissements (cf. Pandémies, Saison II). Cette pression de sélection ne s’applique pas forcément de la même manière dans le monde porcin et humain. Par exemple, les virus humains ont une forte probabilité d’être confrontés plusieurs années d’affilée à l’immunité présente dans la population puisque la vaste majorité des humains vivent de nombreuses années. La majorité des porcs ne vivent pas plus d’une année, car ils sont sacrifiés sur l’autel des côtelettes. Les virus sont donc confrontés de manière moins (ou pas du tout) répétitive à l’immunité de population et l’évolution est bien plus lente. De plus il n’est pas certain que l’immunité du porc vise des cibles identiques à celles de l’homme. Donc évolution à vitesse différente et sélection de changements différents peuvent expliquer pourquoi un H1N1pdm09 différent d’un H1N1 qui a évolué dans la population humaine depuis 1918 a émergé en 2009. En dépit de cette divergence, l’analyse génétique démontre claire-ment une filiation entre H1N1 et H1N1pdm09, pour ce qui concerne les HA et NA.
L’histoire ne s’arrête pas là. On a compris que les possibilités de génération de virus nouveaux, soit par émergence directe du monde aviaire comme en 1918, ou par réassortiments comme en 1957 ou 1968, ou les deux mécanismes combinés pour 2009, ne nous mettent pas à l’abri de nouvelles pandémies. A l’heure actuelle, certains virus aviaires sont très présents aux alentours du monde humain. H5N1, H7N7 ou H2N9 font épisodiquement des ravages dans les élevages intensifs de volaille, ou alors sont régulièrement détectés comme circulant dans le monde aviaire proche des populations humaines. Ce sont de bons candidats à l’adaptation humaine ou au réassortiment avec les virus humains. Certains de ces virus, comme le H5N1, font des infections sporadiques chez les humains, avec des taux de mortalité effrayants (>60%) (cf. Émergence) . Ils n’ont pour l’instant pas acquis la possibilité de se transmettre entre humains. Le suivi de l’évolution de ces virus, une identification rapide en cas d’émergence, la préparation de vaccins dans les temps les plus courts et la disponibilité de médicaments antiviraux demeurent des priorités de nos systèmes de santé publique. Un Plan suisse de pandémie influenza a été édicté (ofsp-plan-pandemie) pour assurer une prise en charge optimale d’une telle situation de crise, le cas échéant.
*La nomenclature des virus de la figure ci-dessus et celle mentionnée dans le texte (hormis H1N1pdm09) est une création maison censée aider la description du processus.
NB. Les informations contenues dans les trois saisons de Pandémies de grippe sont tirées pour la plupart du Fields Virology, chapitre 41, volume 1.
