Dès sa description en 1983 (cf. Émergence d’un virus. Saison III..), le VIH a suscité un effort de recherche exceptionnel tel que, trois décennies plus tard, il est vraisemblablement le virus sur lequel on a le plus d’informations. Cette recherche a permis la disponibilité de toute une batterie de médicaments anti-viraux (ce qui n’est pas la règle en virologie), qui, s’ils sont en mesure de limiter la multiplication virale à un taux non toxique, ne peuvent pas éliminer le virus de l’organisme infecté, autrement dit guérir de l’infection. En parallèle, la plasticité génétique (variation de la carte d’identité virale) est telle qu’aucun vaccin n’est disponible qui pourrait protéger de l’infection. Devant ce double échec, force est de constater que ce n’est pas tant l’incompréhension du virus et des mécanismes d’infection qui fait obstacle que l’impossibilité de mettre en œuvre ce que l’on croit savoir nécessaire à réaliser pour vaincre le mal. Mais, comme souvent revenons aux préliminaires.
L’infection VIH aboutit (sans traitement) à la destruction de la réaction de défense immune dite adaptative. Cette réaction de défense est déclenchée par la réponse innée qui est la première ligne de défense en charge de détecter l’infection et de tenter (avec succès dans plus de 99% des cas) de la résoudre à ce niveau (cf. Comment les virus causent des maladies). Passée cette première barrière, que les virus ont évolué à inhiber ou à détourner, la réponse adaptative mobilise, des acteurs cellulaires appelés lymphocytes (ly). Il en est de deux types, les lyB et les lyT. Les lyT se subdivisent encore en deux types, les lyCD4 et les lyCD8 (ces dénominations dérivent du fait que les lymphocytes exposent à leur surface des protéines appelées respectivement CD4 et CD8). Pour faire vraiment simple, les lyB finissent par produire des anticorps qui vont se fixer sur les virus et les neutraliser et les lyCD8, vont détruire les cellules infectées, pour peu que ces dernières soient le site de production de protéines virales. Mais les lyB comme les lyCD8, ont besoin des lyCD4. Les lyCD4 sont dits « aidants » dans la mesure où les lyB et les lyCD8 ne fonctionnent qu’après contact direct avec les lyCD4. Pas de lyCD4, pas de réponse immune adaptative. Il se trouve que le VIH infecte presque exclusivement les lyCD4 (cf. ci-dessous). En les détruisant, le VIH détruit la réponse immune adaptative. Cette destruction se fait progressivement (en moyenne pendant 10 ans) et ce n’est que lorsque le taux de lyCD4 a diminué de plus de 80% que le syndrome de l’immunodéficience acquise (sida) se manifeste préfigurant la mort suite aux infections opportunistes. Les médicaments anti-VIH bloquent la multiplication virale, donc limitent l’infection et la destruction des lyCD4, empêchant la survenue du sida.
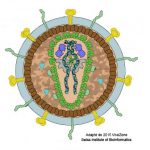
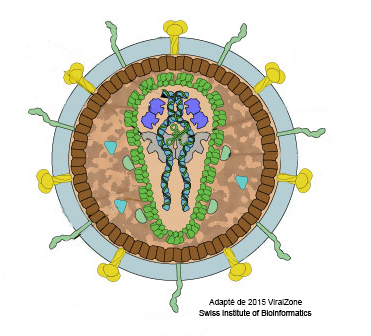
Revenons maintenant au virus et à son cycle de multiplication. Le VIH appartient à la famille des Lentivrus. La particule virale (cf. Figure) est relativement complexe, en ce qu’elle contient beaucoup d’éléments distincts, qui peuvent pour certains avoir été pris à la cellule infectée. Les éléments viraux importants, sont les protéines jaunes (en fait deux protéines dénommées gp120-gp41) qui se fixent sélectivement sur les molécules CD4 présents sur la surface des lymphocytes du même nom, ce qui assure l’infection quasi exclusive de ces cellules. Au centre, à l’intérieur de l’espace limité par des protéines vertes (capside), les deux tortillons bleus-noirs représentent deux copies du génome viral composé d’ARN (cf. Le génome). Deux éléments sont en plus montrés dans la capside, le papillon gris sous-jacent et les hippopotames indigos, figurant, respectivement, la transcriptase inverse et l’intégrase. Un troisième élément en vert clair, la protéase, doit être signalé, présent cette fois dans la zone camouflage. La transcriptase inverse, l’intégrase et la protéase sont des enzymes (terminaison en -ase, cf. La protéine) virales essentielles au cycle de multiplication du VIH. Ce cycle commence avec l’attachement de la particule virale sur le lyCD4 grâce à l’interaction entre gp120 et CD4, jouant dans le contexte le rôle de récepteur pour le virus. Pour que le génome viral puisse entrer dans la cellule, une deuxième interaction spécifique doit avoir lieu, celle entre gp41 et une autre protéine présente à la surface des lyCD4, le co-récepteur CCR5. Après ce checkup, la capside est injectée dans la cellule. Commence alors l’activité de la transcriptase inverse qui copie le génome viral fait d’ARN en ADN. Ce flux d’information génétique ARN à ADN est exceptionnel, car le dogme central de la biologie moléculaire voit l’ARN transcrit à partir de l’ADN et donc le flux d’information génétique aller de l’ADN vers l’ARN (ADN à ARN). La découverte en 1970 de la transcriptase inverse a valu à Howard Temin et David Baltimore, qui l’ont décrite indépendamment, le prix Nobel de médecine et de physiologie. L’ADN viral est ensuite injecté dans le noyau de la cellule où l’intégrase va intégrer ce bout d’ADN viral à l’ADN de la cellule hôte. C’est à partir de ce segment d’ADN qui fait partie maintenant du génome de la cellule infectée (on parle de provirus), que le génome viral (ARN) va être produit par la machinerie cellulaire en grande quantité (cf. Le génome) et c’est à partir de ces génomes viraux que les protéines virales vont être produites pour former de nouvelles particules virales. Pour que ces particules virales soient infectieuses, il faut encore l’activité de la protéase virale dont le rôle est de découper une grande protéine virale en différentes protéines plus petites. La production de nouvelles particules virales mène à la destruction des lyCD4 infectés. En absence de traitement, chaque jour des milliards de particules virales sont produites par des milliards lyCD4 qui sont détruits, mais qui sont remplacés par des milliards de nouveaux lyCD4. Cette bataille titanesque se poursuit avec pourtant un léger avantage pour le VIH qui aboutit à une lente mais sure diminution des lyCD4, jusqu’au moment où leur nombre n’est plus suffisant pour permettre une réponse de défense adaptative efficace. C’est alors l’heure des infections opportunistes, du sida, qui mène à la mort de la personne infectée.
La compréhension du cycle de multiplication du virus, et notamment la description des trois enzymes essentielles à son accomplissement, ont fourni des pistes de recherche visant à bloquer ce cycle de multiplication. Et ce sont des médicaments qui bloquent la transcriptase inverse, l’intégrase et la protéase qui ont été mis au point (entre autres). Lorsque l’une de ces trois fonctions est bloquée, la multiplication virale est enrayée.
Pourtant ce n’est pas si simple. Il faut introduire à ce point la dure réalité de la quasi-espèce. Pour rappel cette notion fait référence au pouvoir d’adaptation extrême dont l’évolution a doté les virus (cf. La quasi-espèce, une hétérogénéité génétique extrême). Un pouvoir d’adaptation fondé sur une capacité à générer une population virale composée d’une multitude de variants génétiques (mutants) prêts à apporter une solution au cas où un problème se poserait. Les médicaments anti- transcriptase inverse, anti-intégrase ou anti-protéase posent un problème au virus. La solution se trouve dans la quasi-espèce. L’administration d’un seul médicament, voit rapidement un variant résistant à ce médicament émerger et continuer l’infection. On a trouvé qu’il faut au minimum trois médicaments dirigés contre trois cibles virales différentes (transcriptase inverse, intégrase et protéase) et administrés conjointement pour ériger une barrière suffisamment forte contre la survenue de virus résistants. On calcule qu’un virus variant qui aurait accumulé trois mutations simultanées permettant la résistance aux trois médicaments serait produit à la fréquence de 1/1000 milliards. De plus, l’accumulation de trois mutations sur un seul génome a une probabilité forte de produire un virus boiteux qui aurait perdu de sa virulence. Voilà l’explication de la trithérapie qui peut bloquer la multiplication virale jusqu’à la rendre indétectable, ce qui permet d’éviter la disparition des lyCD4 et la survenue du sida.
Pourtant ce n’est pas si simple. Il est vrai que dans le cas où la thérapie est suivie correctement, la multiplication virale est diminuée au point d’être indétectable. La personne infectée ne transmet plus le virus, et ses lyCD4, ne diminuant plus, le sida n’est plus une menace. On pourrait conclure que la personne est guérie. Il n’en est rien. Si le traitement est arrêté, invariablement, le virus réapparaît, et recommence son travail de sape. Pour comprendre ce qui se passe, il faut revenir au cycle de multiplication du virus, à l’étape où après l’entrée du génome viral et sa conversion en ADN, ce dernier est intégré dans le génome du lyCD4 infecté (provirus). En tant que tel, ce supplément d’ADN, s’il n’est pas exprimé, n’est en rien une gêne pour le lymphocyte. Par « exprimé », on entend que l’information génétique qu’il contient donne naissance à des protéines virales et conduit à la multiplication du virus. Il se trouve que cette expression n’est pas obligatoire, ce qui fait que dans un certain nombre de lyCD4 infectés, l’information reste dormante. Sous cette forme dormante, le virus est inattaquable. S’il n’y a pas de multiplication virale, il n’y a rien à bloquer, et les médicaments anti-viraux sont totalement inutiles. Il s’avère ainsi, que lorsque le virus n’est plus détectable, il reste néanmoins un réservoir de lyCD4 infectés qui contiennent un génome viral dormant. Si le traitement est arrêté, il y a toujours un certain nombre de lyCD4 qui se réveillent et se mettent à produire du virus. Ce qu’il faudrait réussir à faire, c’est de purger ce réservoir de lyCD4 infectés silencieux. Et ça, on ne sait pas encore faire. C’est une voie de recherche très active, tant elle est importante pour pouvoir envisager la guérison de la personne infectée. Pour l’instant, la personne infectée doit prendre des médicaments à vie. Il faut une sacrée discipline, une volonté permanente, surtout que les médicaments ne sont pas toujours bien tolérés.
Pour l’instant, la meilleure des solutions reste celle d’éviter l’infection, éviter les comportements à risque et se protéger. Qu’en est-il du vaccin ? Ne pourrait-il pas, comme dans le cas des virus de la rougeole ou de l’hépatite B prévenir l’infection ? Dans le cas du VIH, ce n’est pas si simple. Un vaccin est basé sur une « carte d’identité » du virus qui peut être présenté à l’organisme dans un contexte où la virulence a été atténuée ou éliminée (cf. La vaccination). Cette carte d’identité doit être clairement définie et ne pas varier entre le moment de la vaccination et celui de l’infection. Pour le VIH, ces deux conditions ne sont pas remplies. Bien que l’infection par le VIH suscite la production d’anticorps (on dit bien que les infectés sont séro-positifs), ces anticorps ne donnent pas vraiment l’identité du virus. C’est comme si le passeport affichait une main, un bras ou une jambe de la personne et non son visage bien identifiable. De plus, même si on finissait par avoir le « visage » du virus sur sa carte, il se trouve que ce visage se modifie avec le temps. De nouveau le problème des variants génétiques vient compliquer la lutte du système de défense contre le virus. A peine des anticorps sont produits qui bloquent le virus, que déjà ces anticorps deviennent inefficaces car ils ont servi à sélectionner un variant qui échappe à ces anticorps. Ici encore, on sait ce qu’il faudrait faire : identifier un élément du virus qui serve de vraie carte d’identité (le vrai visage du virus) et qui ne peut pas varier. C’est à dire un élément tellement essentiel pour la survie du virus que s’il change le virus perd sa virulence. On sait très bien ce que l’on cherche, mais on n’a pas encore trouvé. Le VIH rejoint ici le virus de l’hépatite C, contre lequel un vaccin n’a pas encore été produit, et ce pour les mêmes raisons (cf. Les virus des hépatites…). La différence avec le virus de l’hépatite C vient du fait que pour ce dernier ’il n’y a pas de virus dormant. Les médicaments peuvent faire leur effet jusqu’à l’élimination du virus de l’organisme infecté. Pour conclure sur la variabilité génétique, il faut mentionner celle de la population humaine, qui donne, cette fois, un avantage face au VIH. Dans 30% de la population du nord de l’Europe, une mutation dans le co-récepteur CCR5 confère une résistance naturelle à l’infection. Cette mutation, qui consiste en la perte d’une petite partie de la protéine humaine, sans conséquence pour sa fonction normale, empêche la reconnaissance par la gp41 virale, ce qui bloque le processus d’infection (cf. ci-dessus).
Cette article est l’occasion de présenter le schéma d’un cycle de multiplication virale. Il contient des étapes qui n’ont pas été discutées. On peut essayer de les suivre néanmoins avec les explications données dans la légende.